
2025年12月2日,中山大学林东昕、郑健、黄旭东共同通讯在Cell Metabolism(IF=30.9) 在线发表题为“Extracellular vesicles from obese visceral adipose promote pancreatic cancer development and resistance to immune checkpoint blockade therapy”的研究论文,该研究发现来自肥胖内脏脂肪的细胞外囊泡促进胰腺癌的发展和对免疫检查点阻断疗法的抵抗。

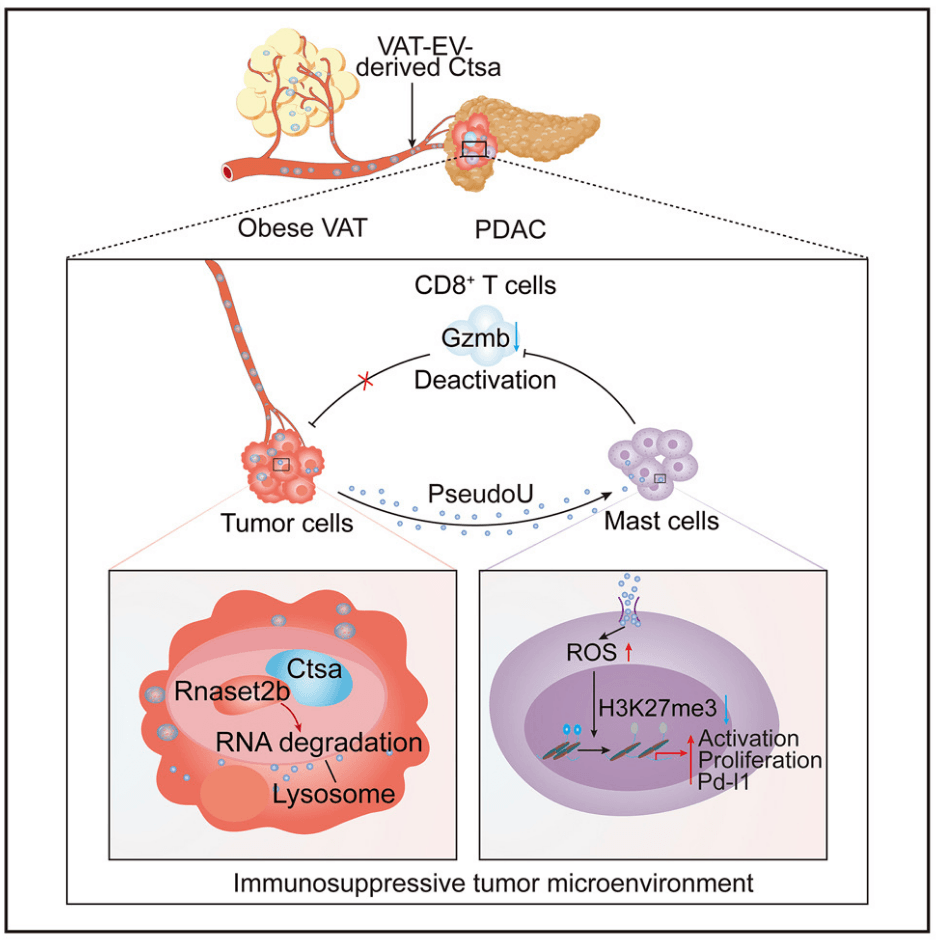
在这里,研究人员表明,肥胖的内脏脂肪组织(VATs)可以通过传递携带信号分子的细胞外囊泡(EVs)与远处的PDAC进行交流。该研究揭示了PDAC细胞可以将VAT-EVs带入其溶酶体,在溶酶体中,EV递送的组织蛋白酶A (Ctsa)稳定核糖核酸酶Rnaset2b以产生游离的假尿苷。假尿苷通过增加活性氧簇(ROSs)和减少基因启动子的H3K27me3修饰来激活肥大细胞。活化的肥大细胞抑制CD8+ T细胞活性,形成免疫抑制肿瘤微环境,促进癌症进展。动物实验表明Ctsa敲除有效地增强了ICB对PDAC的疗效。该研究揭示了连接肥胖和癌症的VAT-EV CTSA-假尿苷-肥大细胞轴,这为开发肥胖相关癌症的新治疗策略带来了希望。
最近的证据强调VAT衍生的细胞外泡(VAT-EVs)可能在这些过程中发挥作用。然而,对于EVs是否能够介导VAT和远端肿瘤(如肥胖背景下的PDAC)之间的联系,知之甚少。 此外,如果肥胖的VAT-EVs可以与肿瘤交流,那么信号分子是什么?它们是如何发挥作用的?阐明这些问题对于肥胖相关癌症的干预和临床治疗都具有重要意义。
EVs促癌机制:肥胖内脏脂肪释放的EVs富含促炎因子(如IL-6)和癌基因miRNA(如miR-155),这些成分被胰腺癌细胞摄取,激活细胞内NF-κB和PI3K/AKT信号通路,导致癌细胞增殖和转移能力增强。实验中,暴露于肥胖EVs的胰腺癌细胞,侵袭性提高约40%。
免疫抵抗机制:EVs还上调肿瘤细胞的PD-L1表达,同时抑制T细胞活性,造成免疫微环境“冷化”。在接受免疫检查点阻断疗法的小鼠模型中,添加肥胖EVs后,治疗有效率从60%降至20%,证实了直接抵抗作用。
实验数据强调,EVs作为“肥胖-癌症”桥梁,其分泌量在肥胖个体中显著增加(比正常体重高2-3倍),且这种效应主要通过内脏脂肪(而非皮下脂肪)介导。
研究表明,肥胖的内脏脂肪组织(VATs)可通过分泌携带信号分子的细胞外囊泡(EVs)与远处的PDAC进行通讯。我们发现PDAC细胞能将VAT-EVs摄入溶酶体中,其中EV递送的组织蛋白酶A(Ctsa)可稳定核糖核酸酶Rnaset2b以产生游离假尿嘧啶。假尿嘧啶通过增加活性氧(ROSs)和降低基因启动子处的H3K27me3修饰来激活肥大细胞。活化的肥大细胞会抑制CD8+ T细胞活性,形成一种免疫抑制性肿瘤微环境以促进癌症进展。动物实验表明,Ctsa基因敲低能有效增强免疫检查点阻断(ICB)对胰腺癌(PDAC)的疗效。我们的研究发现了一条连接肥胖与癌症的内脏脂肪组织(VAT)细胞外囊泡CTSA-假尿嘧啶-肥大细胞轴,这为开发肥胖相关癌症的新型治疗策略提供了新思路
该研究证实,来自肥胖个体的内脏脂肪组织分泌的细胞外囊泡(EVs),通过携带特定分子信号,驱动胰腺癌细胞增殖、侵袭和免疫逃逸,从而降低免疫检查点阻断疗法(如PD-1抑制剂)的有效性。这一发现为理解肥胖相关癌症风险提供了新机制,并为开发靶向EVs的干预策略指明了方向。
肥 胖
肥胖与多种癌症的发生发展存在关联,而肥胖的胰腺导管腺癌(PDAC)患者预后不佳且对免疫检查点阻断(ICB)疗法具有耐药性。其分子机制尚不完全清楚。

脂肪不仅是能量仓库,更可能是癌症的帮凶
肥胖的“毒仓库”:内脏脂肪暗藏杀机
中山大学团队发现:
肥胖者内脏脂肪量 ≈ 正常体重者的3-5倍
这些脂肪不是沉默的“能量包”——它们像被激活的“生化工厂”,持续释放携带致癌物质的细胞外囊泡(EVs),随血液直抵胰腺。
肥胖的双重暴击
1喂饱癌细胞
肥胖EVs使胰腺癌细胞增殖速度提升300%
肿瘤转移风险增加2.5倍
2废掉免疫治疗
给癌细胞披上“隐身斗篷”(激活PD-L1蛋白)
清除抗癌战士T细胞,形成“免疫荒漠区”
导致免疫药物(如PD-1抑制剂)有效率暴跌40%
胰腺被内脏脂肪紧密包裹(如“汉堡中的肉饼”),成为EVs攻击的首个靶标!
总之,这项研究不仅深化了我们对细胞外囊泡在癌症发展中的作用认识,还为免疫治疗抵抗提供了破解路径。它在细胞层面揭示肥胖的致癌机制,提示通过干预EVs通路可能成为癌症预防和治疗的新突破口,未来需进一步探索临床转化方案
肥胖不是“亚健康”,而是一场体内生化战争!
中山大学的发现证明:减掉1公斤内脏脂肪=拆除一个“肿瘤加速器”。对抗“癌王”胰腺癌,从管理腰围开始!
参考文献
[1]https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00475-9
【本文数据选自期刊 详细数据请自行下载】
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

