
Zeinab Shirbaghaee等人在《Stem Cell Research & Therapy》发表了一项关于严重肢体缺血(CLI)的1期临床试验,据文中所述,该研究团队采用胎盘来源的MSCs治疗9名CLI患者,术后取得了令人鼓舞的治疗结果(试验注册:IRCT,IRCT20210221050446N1)间充质干细胞治疗重症下肢缺血是安全的,可以进血管生成、促进伤口愈合、使患者疼痛减轻。

这项研究试验中纳入了9名CLI患者:2名糖尿病足患者和7名TAO患者。
符合条件的患者被随机分为两个P-MSC给药队列之一。 A 3 + 3 采用剂量递增方法,每个P-MSC剂量队列中有3-6名患者:20 × 106 细胞(低剂量)和60 × 106 细胞(高剂量)。使用先前临床研究的数据选择剂量水平。三名参与者被分配到第一组。当这些人进行第14天的评估时,一个无偏见的安全监测委员会审查了安全性证据,以确定是否可以在第二组中再招募三名受试者,直到达到MTD。如果在随访的前14天内没有超过一名患者患有DLT,则第二组的受试者人数增加到6人。
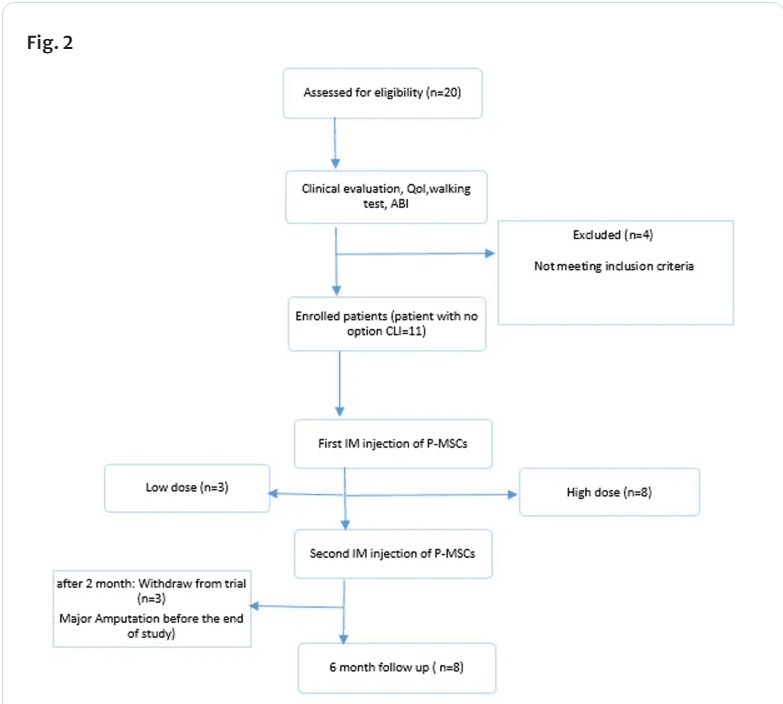
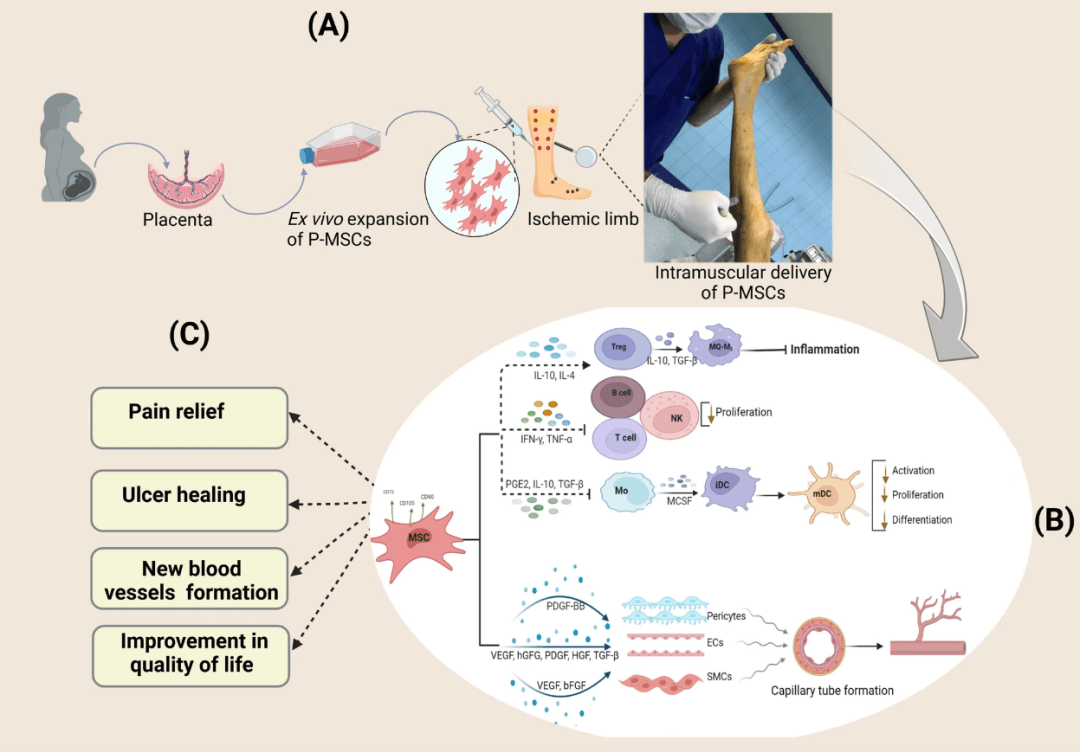
P-MSC治疗在两个时间点进行,相隔八周。使用30G针头将悬浮液的总量肌肉注射至1-1.5cm的深度和10 × 6 cm(30-40个位点,每个位点0.5-1.0 ml P-MSCs)。注射分布如下:膝盖到脚踝被分成四条线的五个相等的部分(腿的前部、前外侧和后浅部),在足背和伤口周围(如果有伤口)确定了六个点
所有患者在细胞治疗前后均接受了常规血液学和生化检测。结果表明,随着时间的推移,测试有所改善。其中空腹血糖明显下降(P ˂ 0.0273)
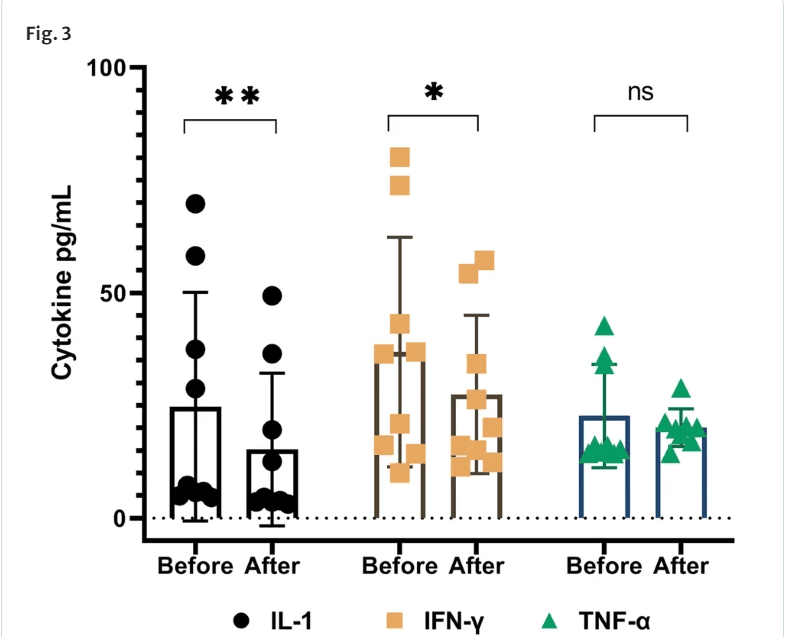
首次输注后第0天(基线)和6个月患者血清炎性细胞因子水平的变化。首次输注前(基线)和输注后6个月的生物标志物分析表明,所有CLI患者的IL-1和干扰素-γ(IFN-γ)显著降低。4例患者血清肿瘤坏死因子α(TNF-α)水平降低,但差异无统计学意义。 P < 0.05;ns,不显著
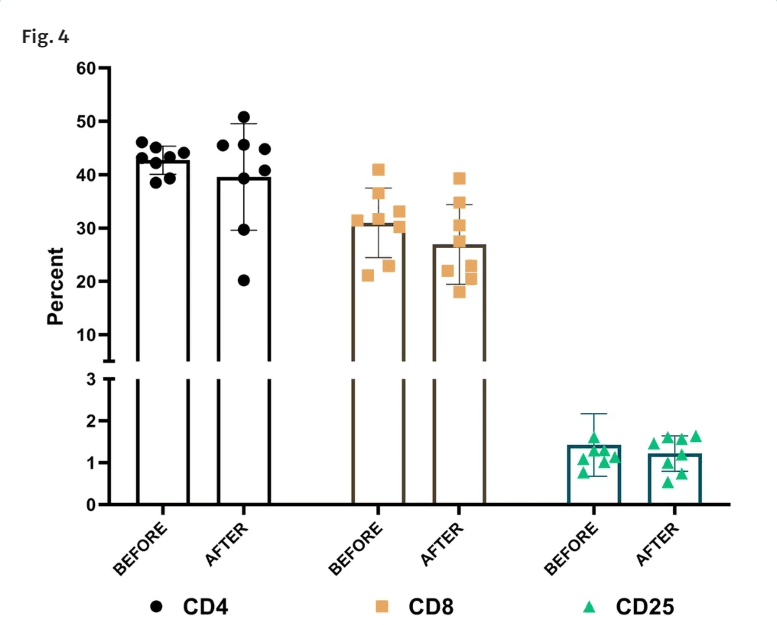
在用P-MSCs治疗前后,使用流式细胞术分析患者样本的CD4、CD8和CD25标志物(图4)根据获得的各种T淋巴细胞亚群的数据,CLI参与者的血液淋巴细胞谱没有明显变化,这意味着注射的同种异体细胞不会导致体内T细胞增殖。总之,这些发现表明,CLI患者的免疫状况没有受到异基因P-MSC给药的不利影响,并且是完全安全的。
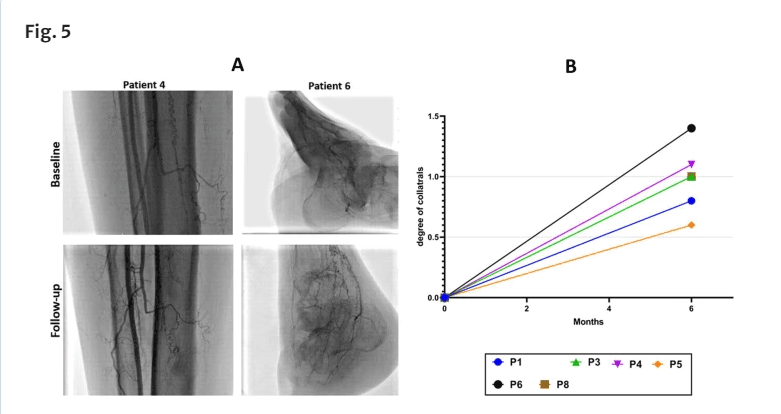
评估了细胞注射后6个月的动脉血管造影数据,并将侧支血管发育程度分为+ 0(无抵押品流通)+ 1(轻微的侧支循环)+ 2(适度的抵押品循环),以及+ 3(高侧支循环)[36,37]。血管造影评估由三名心脏病学家进行,他们对患者的临床状况一无所知。细胞输注后,侧支血管形成评分升高至0.98 + 0.3(图5)。
在试验开始时以及1个月、3个月和6个月的随访时,使用VAS评估静息痛(表3)。在完成随访期的肢体中,所有患者的疼痛都有明显改善。平均VAS基线评分为8(± 0.75),提高到3.87(± 1.24) 3个月后为1.125(0.83)(P˂0.0001)(图6A)
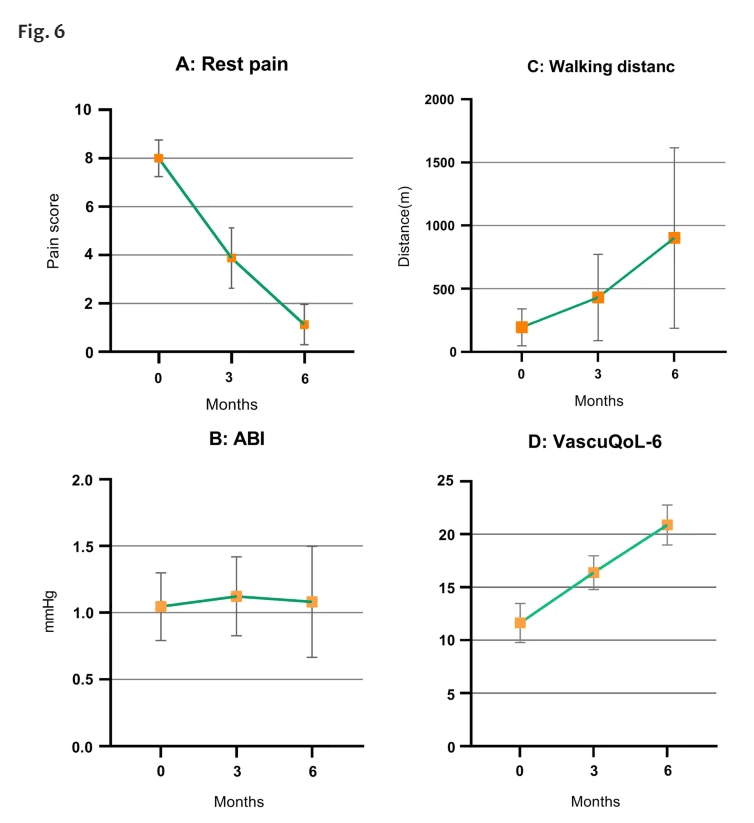
研究结果表明,细胞植入后所有参与者的身体功能和休息疼痛都显著改善。一名患者在六个月的随访前接受了截肢手术,但注射的腿明显改善。所有参与者都对他们的结果感到满意,观察到休息疼痛的缓解导致活动表现显著提高,尤其是连续行走,镇痛药的使用显著降低。
在6个月的随访期间,一条肢体的溃疡明显愈合,两条患有溃疡和坏疽的肢体没有进展,完全干燥。我们在细胞治疗前对一名患者和P-MSC植入后对五名患者进行了轻微截肢,截肢后伤口愈合,溃疡表面总测量值大大降低(图7)。
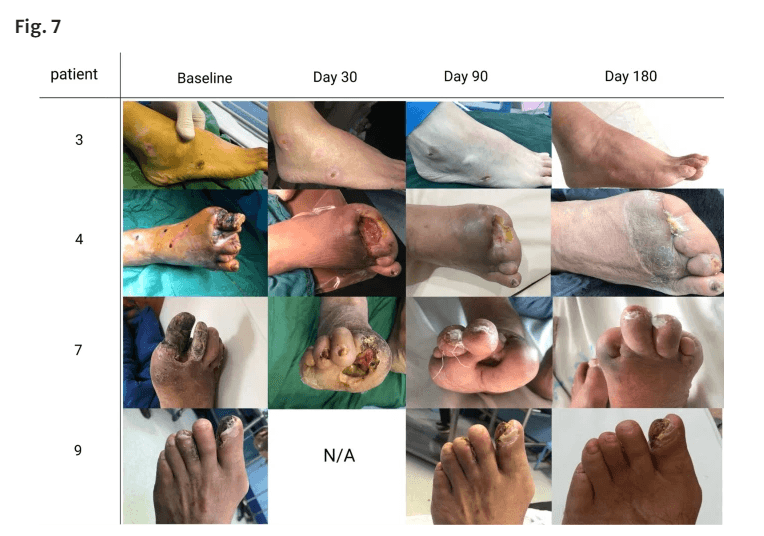
在六个月的随访中,该试验的截肢率为40%(10条肢体中有4条)。在9名患者中,4名接受了截肢,其中3名被诊断为需要大截肢。转诊临床医生一致认为,P-MSC治疗后,第一种治疗方法不再有效。因此,他们接受了轻微截肢。只有一名患者在细胞治疗后第70天接受了大截肢(由于坏疽部位的双重感染),并在随访结束前被排除在试验之外。
总之,在这项早期临床试验中的观察表明,大剂量P-MSCs肌肉注射治疗是安全的,耐受性良好,可以显著改善CLI患者的身体机能,并最大限度地减少炎症状况。
什么是重症下肢缺血
重症下肢缺血(Critical Limb Ischemia, CLI)是外周动脉疾病的终末阶段,严重肢体缺血(CLI)是PAD最严重的形式,可导致缺血性静息痛、伤口未愈合、坏疽和截肢。血管内血运重建或开放手术是目前改善受影响肢体血流的标准治疗方法。然而,由于内部血管解剖不充分或手术风险高,20-40%的人没有资格接受这些治疗。全球约2000万患者,每年新增250万例。

下肢严重缺血(CLI)会增加组织坏死风险,导致显著的发病率和死亡率。采用细胞疗法,尤其是间充质干细胞(MSCs),促进治疗性血管新生对改善CLI患者缺血区域的血流量至关重要。
间充质干细胞(MSCs)因其独特的生物学特征而被视为治疗严重肢体缺血的再生疗法。MSCs具有发育成内皮细胞(EC)并产生血管生成因子的能力。因此,它们可以促进组织再生,改善功能,诱导血管生成,恢复缺血区域的血液循环。
干细胞治疗机制
间充质干细胞(MSCs)治疗下肢缺血的机制核心在于三重协同作用,通过细胞级联反应修复受损组织,具体过程如下:
01血管新生(核心机制)
分泌血管生长因子
MSCs持续释放 VEGF(血管内皮生长因子)、FGF(成纤维细胞生长因子)和HGF(肝细胞生长因子),直接刺激血管内皮细胞增殖,促进新生毛细血管形成。
分化为内皮细胞
约15-20%的MSCs在缺血区域分化为血管内皮细胞,直接参与构建微血管网络,增加局部血供
02抗炎与免疫调节
抑制炎症风暴
分泌IL-10、TGF-β等抗炎因子,抑制促炎因子(TNF-α、IL-1β)释放,减轻组织水肿和炎症损伤。
调控免疫细胞
将巨噬细胞从促炎的M1型转化为修复型的M2型,同时抑制T细胞过度活化,阻断炎症恶性循环。
03抗凋亡与组织保护
阻断细胞死亡程序
通过PI3K/Akt信号通路激活细胞生存路径,减少缺血区内皮细胞和肌细胞的凋亡。
清除氧化应激
分泌超氧化物歧化酶(SOD)、谷胱甘肽等抗氧化物质,中和自由基,保护线粒体功能。
04细胞外基质重塑
分泌胶原与弹性蛋白
修复受损血管基底膜,改善血管壁弹性,增强新生血管稳定性。
抑制纤维化
下调MMP-9等基质金属蛋白酶活性,阻止瘢痕组织过度形成。
参考文献
[1]《Stem Cell Research & Therapy》
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

