
2025年10月,由温州医科大学附属衢州医院等中国科研团队领衔的一项突破性研究发表在《Stem Cell Research & Therapy》期刊上。研究团队创新性地聚焦于人诱导多能干细胞(iPSC)分化来源、并经过CD146分子筛选富集的间充质干细胞(iPSC-CD146+MSCs),对其在溃疡性结肠炎(UC)模型中的治疗效果和作用机制进行了深入探索。

CD146+iMSC和CD146+UCMSC的分类
分别设立三组:空白对照组(对照组)、脂多糖(LPS)诱导的炎症模型组(LPS组)和干细胞共培养干预组(CD146+iMSCs组)。然后,除对照组外,向所有组中加入1µg/mL LPS以诱导炎症模型。在CD146+iMSC组中,IEC-6和HIEC以3的密度接种在六孔Transwell板的下腔室中 × 10⁵ 每孔细胞数和MSCs以2 × 10⁵ 每孔细胞数。36小时后,收获IEC-6或HIEC用于进一步实验。
C57BL/6小鼠(6-8周龄)采用随机数字表法分为两组:尾静脉注射组和腹腔注射组(n = 6 每组),每组进一步细分为对照组和DSS组(n = 3 每组)。CD146+iMSC与10µM DIR溶液在37℃的培养箱中共孵育30分钟。然后1 × 106 DIR标记的CD146+iMSC分别通过腹腔注射或尾静脉注射注射到DSS组的小鼠体内。在注射后第1、3、7、14、21和28天使用小动物体内成像系统捕获细胞的荧光图像。
iMSC和UCMSC的采集和鉴定
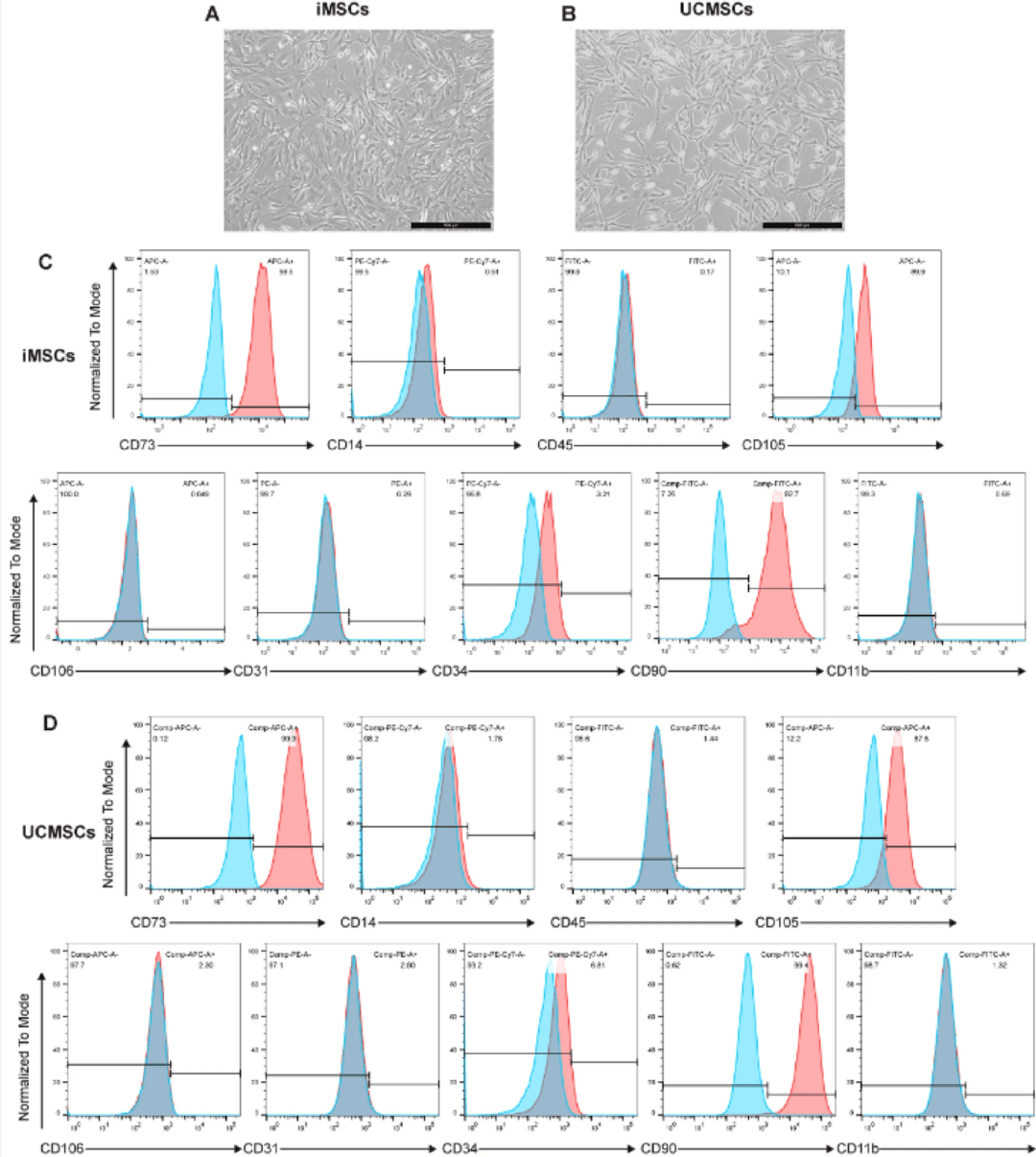
冷冻保存的iMSC解冻并扩增至第4代(P4),表现出典型的成纤维细胞样形态(图1A)。使用标准分离方案成功获得UCMSC并培养至P4,显示出相似的形态特征(图1B)。流式细胞术分析显示,这两种细胞类型都表达典型的MSCs标志物(CD73、CD90和CD105;阳性率 > 95%),而造血/内皮谱系标志物(CD11b、CD14、CD31、CD34、CD45和CD106)呈阴性(图1C、D)
该实验使用CD146免疫磁珠分离获得了CD146+iMSC和CD146+UCMSC(图2A)。流式细胞术分析显示,分离前iMSCs和UCMSCs中CD146+细胞的比例分别为15.5%和25.7%,分离后两种细胞类型的纯度均超过97%(图2B)。磁珠分离过程不影响细胞形态,两种干细胞亚群都保持了典型的纺锤形贴壁生长特征(图2C)。如图2D所示,分化实验表明,CD146+iMSCs和CD146+UCMSCs都具有成脂和成骨分化潜力。
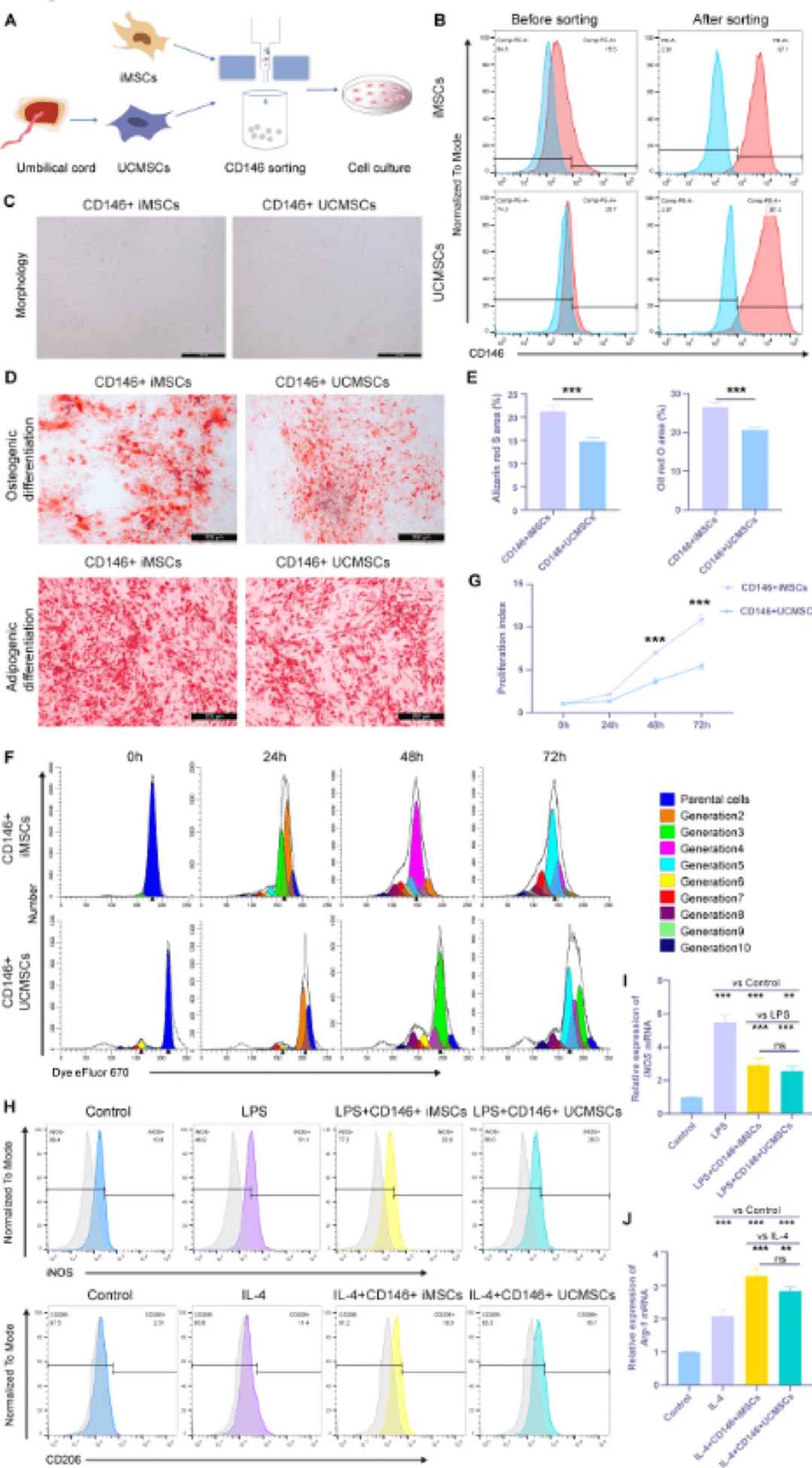
CD146+iMSCs和CD146+UCMSCs的生物学特性。磁珠分选示意图
这些结果表明,CD146+iMSC可能通过抑制TNF信号通路发挥抗炎作用。在细胞成分(CC)方面(图3F),差异表达的基因在细胞外基质和质膜的整体成分中显著富集,表明CD146+iMSC可能具有增强的细胞表面相互作用能力和分泌功能,这对于修复UC中受损的肠粘膜物理屏障至关重要。差异表达的基因在分子功能(MF)水平上明确富集,如信号受体调节活性和受体配体活性(图3F)
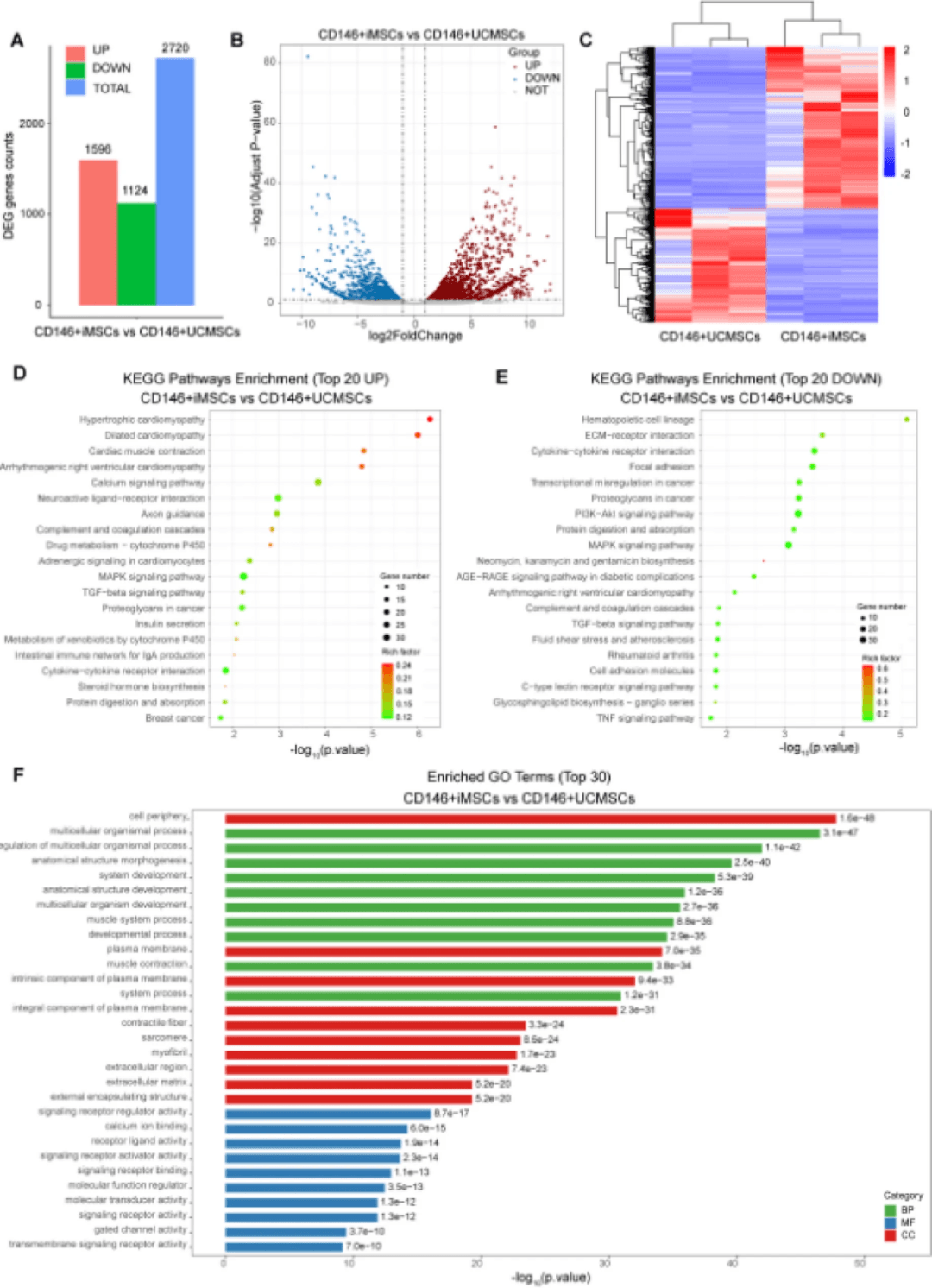
CD146+iMSCs和CD146+UCMSCs的转录组测序
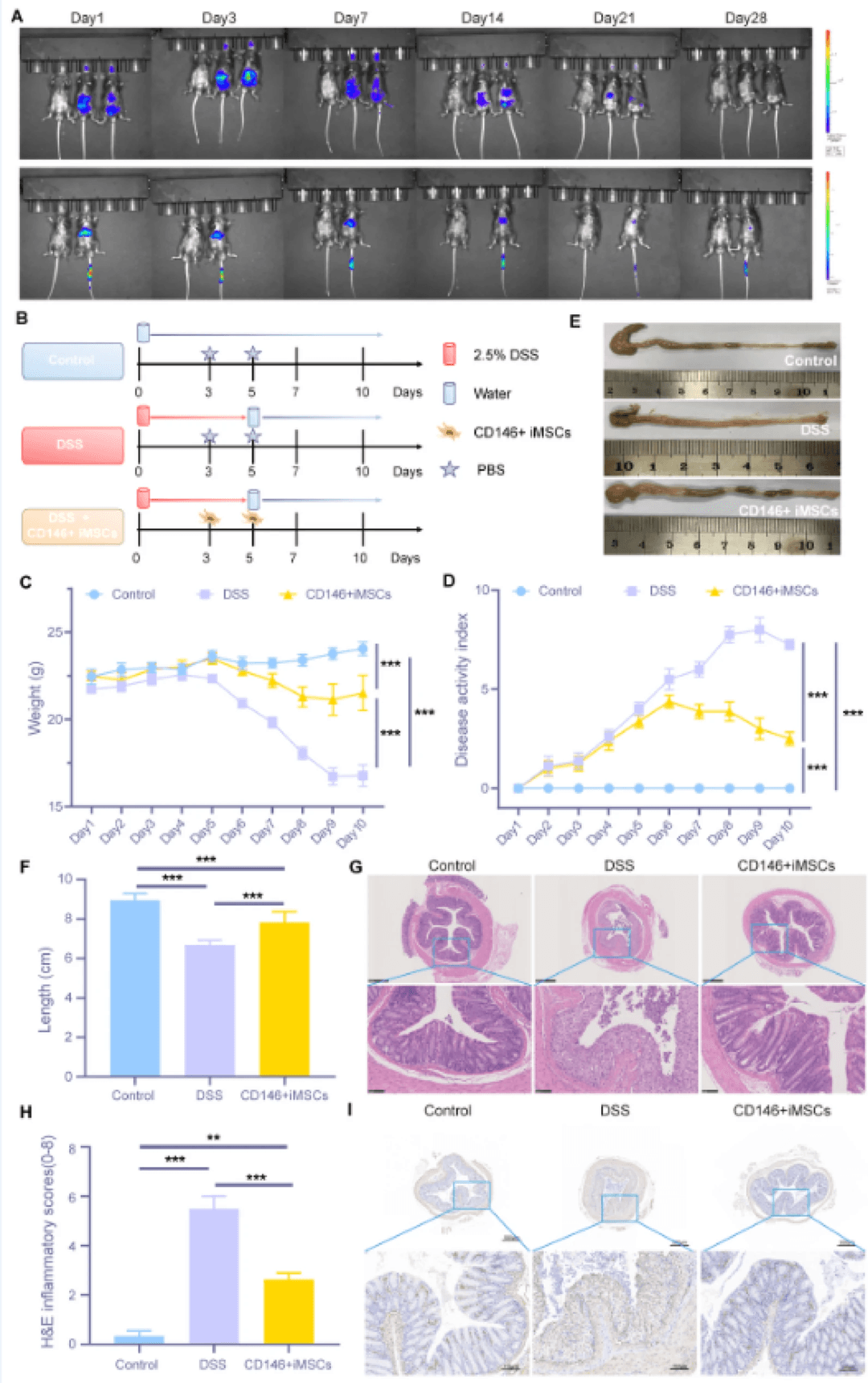
首先使用小动物体内成像系统比较了通过腹腔注射和尾静脉注射给予的CD146+iMSC的体内生物分布。发现,腹腔注射组的荧光信号主要在小鼠腹部区域富集,并持续更长时间(图4A)。因此,选择腹腔注射进行后续治疗实验。如示意图(图4B)所示,建立了小鼠UC模型,并通过腹腔注射给予CD146+iMSC,以系统评估其治疗UC的疗效。DSS组小鼠的体重在建模过程中显著下降,而CD146+iMSCs组的体重减轻与DSS组相比显著减轻(图4C)。与DSS组相比,CD146+iMSCs组的疾病活动指数得分显著降低(图4D)。我们进一步检查了结肠的长度和形态。与对照组相比,DSS组的结肠明显缩短并出现充血和水肿,而CD146+iMSCs组的结肠长度缩短较少,红肿有所改善(图4E,F)。H&E染色显示DSS组结肠隐窝结构异常,炎性细胞浸润异常,而CD146+iMSCs组隐窝结构和上皮细胞结构保存较好,组织病理学活性指数较DSS组降低(图4G,H)。
与DSS组相比,CD146+iMSC组中的Zonula Occludens-1(ZO-1)蛋白表达模式与对照组相似,保持了完整的上皮屏障结构(图4I)。这些发现强烈表明,CD146+iMSC可以有效缓解DSS诱导的小鼠溃疡性结肠炎。
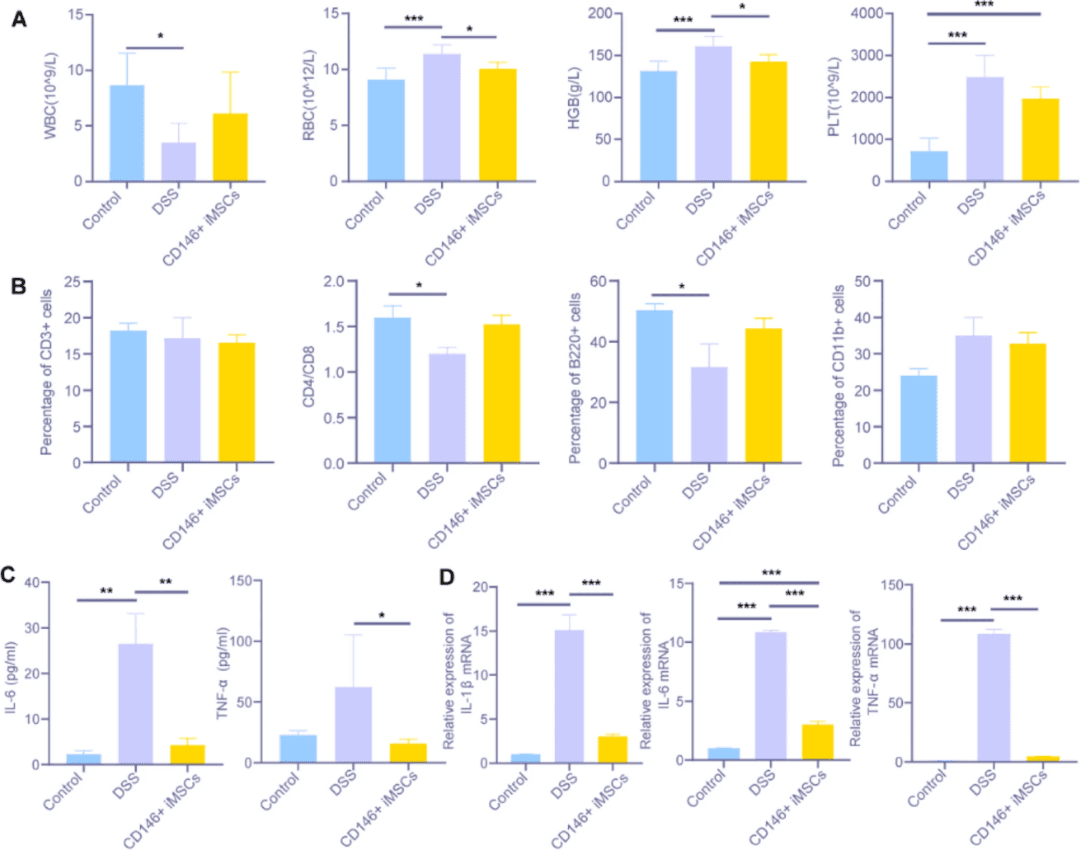
为了阐明CD146+iMSC在缓解UC中的免疫调节作用,该研究记录了炎症参数的协调变化。外周血检测结果显示,DSS组出现典型的炎症性血液改变,其特征是白细胞(WBC)减少,红细胞(RBC)、血小板(PLT)和血红蛋白(HGB)异常升高。CD146+iMSCs治疗逆转了这些异常指标,显著将外周血计数恢复到与对照组正常小鼠相当的水平(图5A)。
发现证实了CD146+iMSC通过影响细胞因子和淋巴细胞来抑制炎症反应。这些协调的变化值得进一步研究,并为制定基于CD146+iMSCs的UC治疗计划奠定了基础。
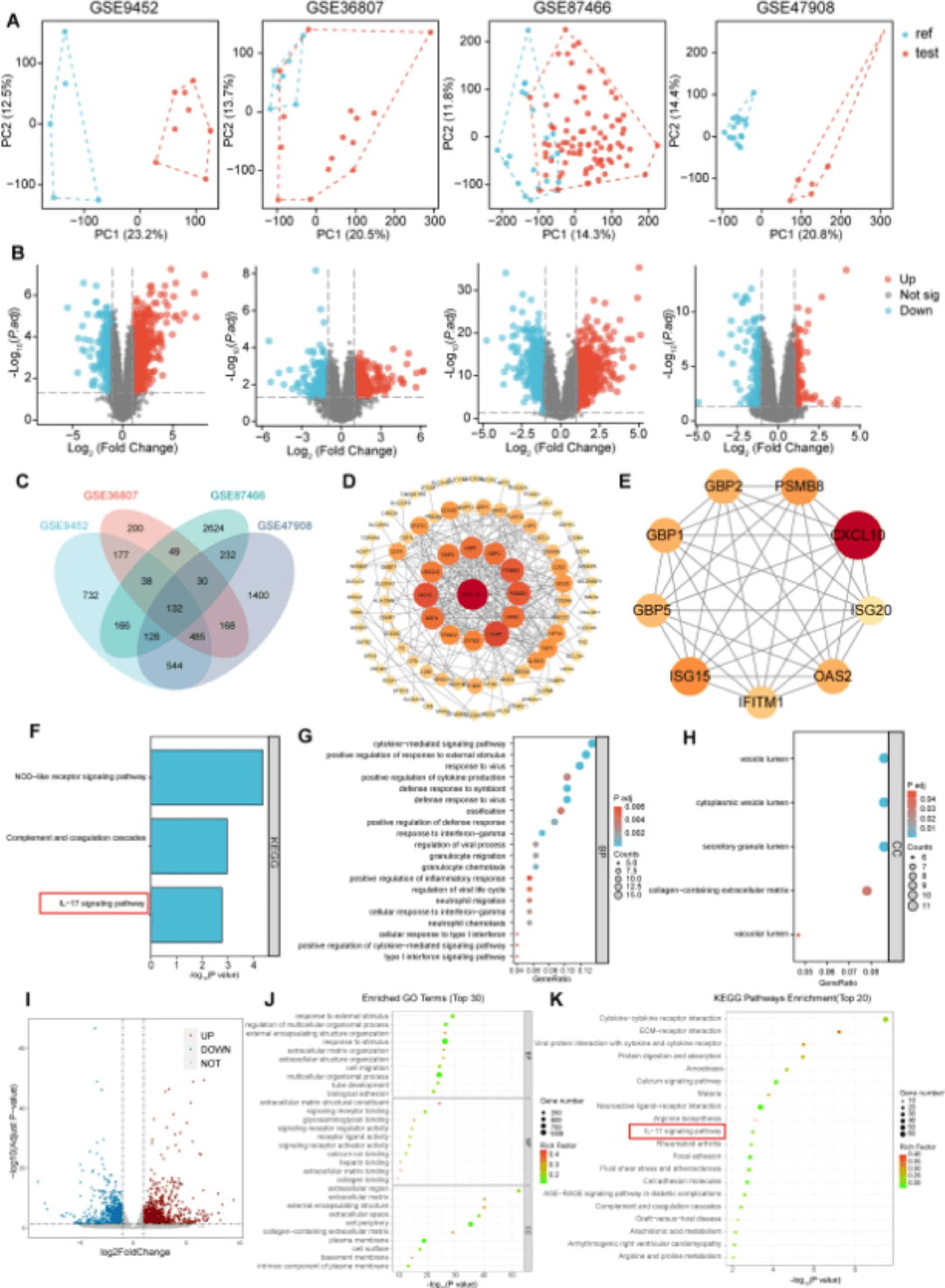
如图6A所示,PCA结果表明,在四个数据集中,健康对照组和UC组样本之间存在明显的空间分离。
小鼠结肠测序结果显示,与对照组相比,DSS组发现2177个DEGs(图6I)。图6J显示了GO分析的TOP10结果,显示这些DEGs与生物过程有关,如对外部刺激的反应、多细胞生物过程的调节和细胞迁移。此外,这些基因参与细胞成分,包括细胞外周、质膜和细胞外区。此外,它们还参与了信号受体结合、钙离子结合、受体配体活性和细胞外基质结合等分子功能。
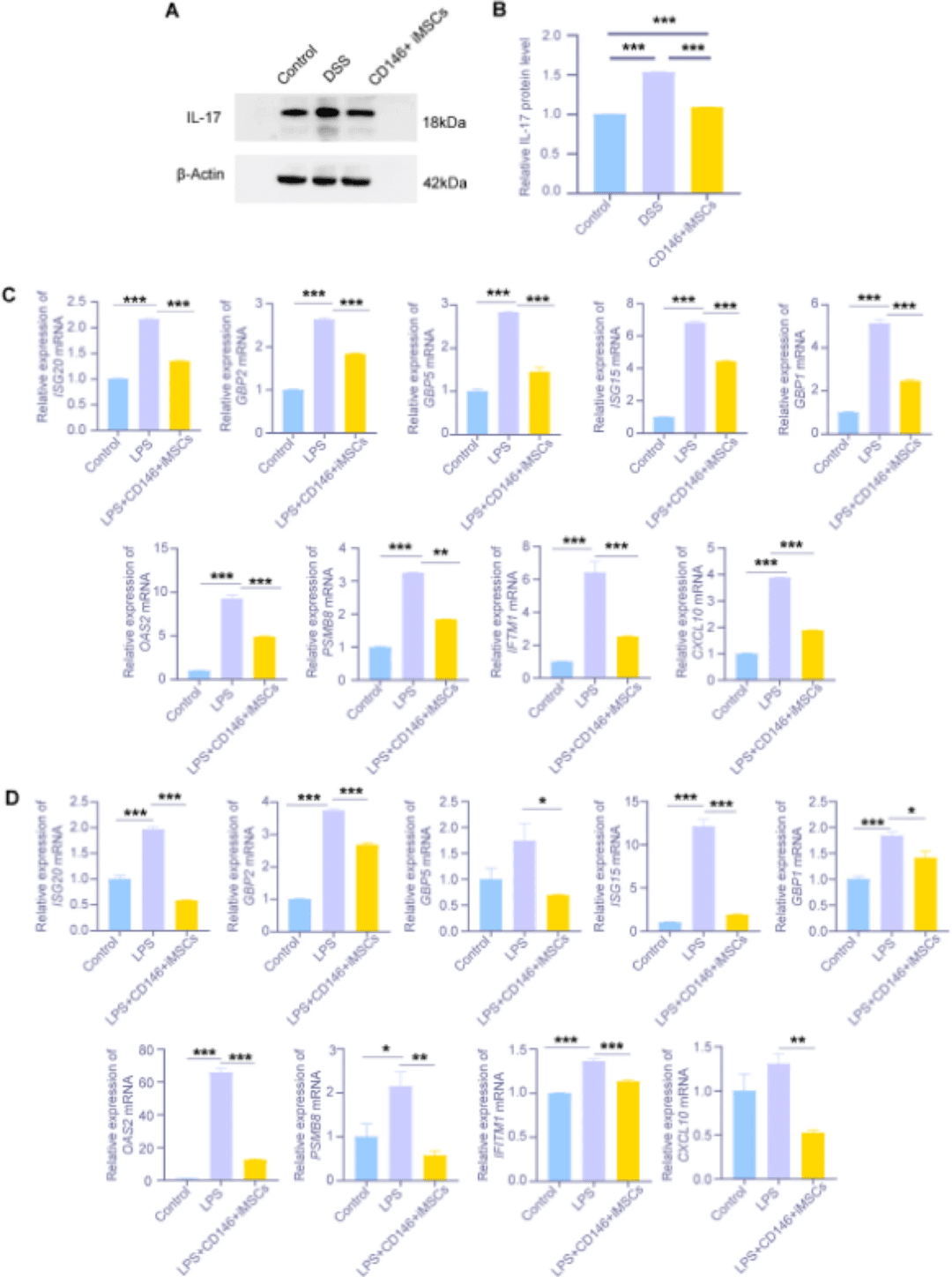
结肠组织的WB分析显示,DSS组IL-17表达显著上调,在CD146+iMSC治疗后显著下调(图7A,B)。在LPS诱导的炎性细胞共培养模型中,与LPS组相比,CD146+iMSC显著降低了HIEC和IEC-6中9个HUB基因的表达(图7C,D)
WB分析进一步表明,CD146+iMSC可以下调LPS诱导的巨噬细胞中cGAS STING途径中蛋白质的表达(图8C,D)。这些发现表明,CD146+iMSC可能抑制巨噬细胞从M0表型向M1表型的转变,至少部分是通过抑制cGAS STING信号通路,从而改善结肠炎症。
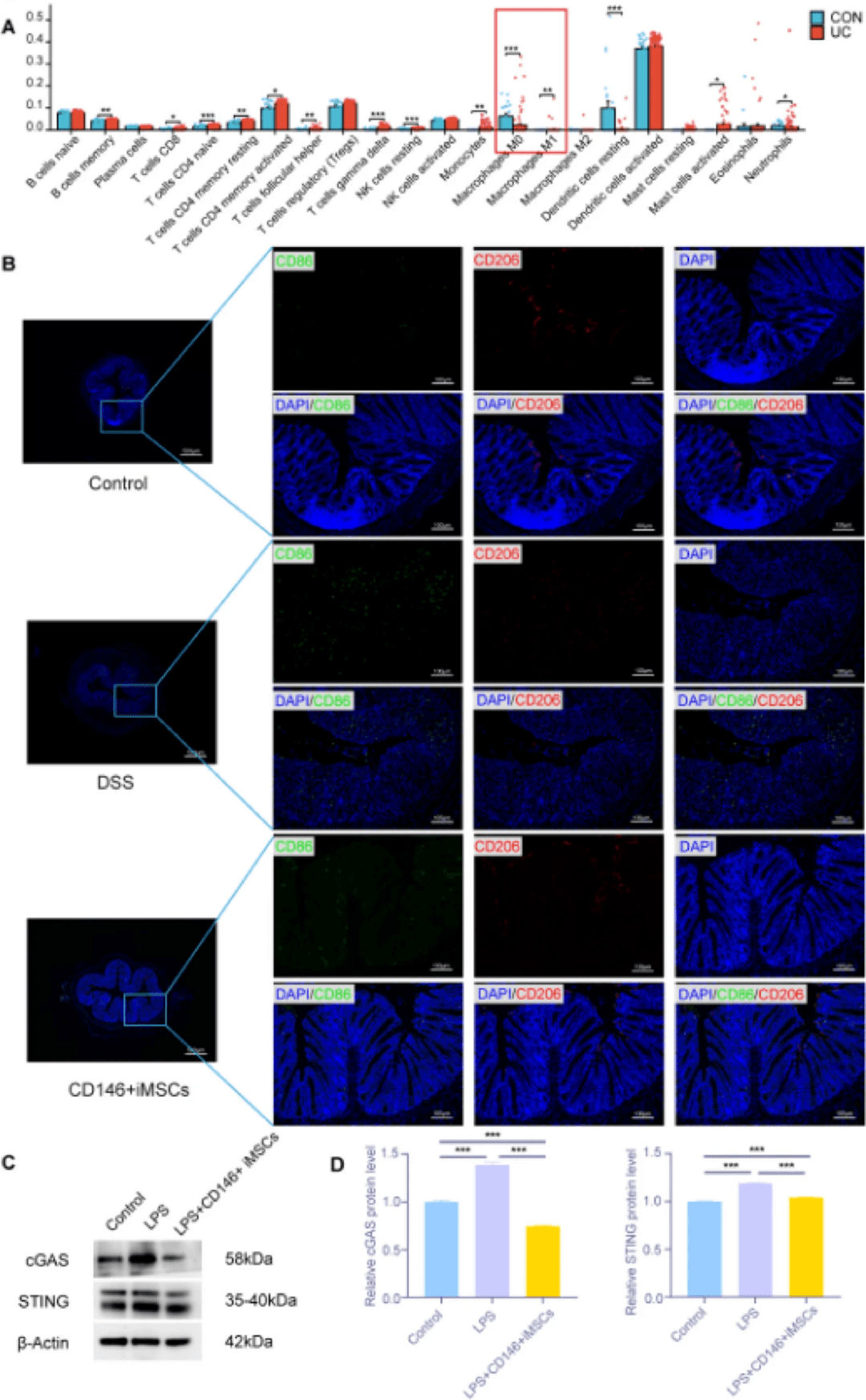
研究发现,CD146+iMSCs治疗显著降低了结肠组织中IL-17的蛋白表达水平,表明该途径可能介导CD146+iMoSCs的免疫调节作用。IL-17是一种促炎细胞因子,主要由Th17细胞和γδT细胞等免疫细胞分泌。它通过激活NF-κB和MAPK通路促进炎症反应,并可以与TNF-α等因子协同放大炎症信号。
CD146+ iMSC显著改善了UC症状(体重、DAI),减少了结肠损伤,降低了IL-6/TNF-α,恢复了免疫平衡。结肠转录组测序数据和GEO数据集的综合分析揭示了IL-17信号通路在CD146+iMSC治疗效果中的关键作用。
结论
研究表明与CD146+UCMSCs相比,CD146+iMSCs具有更优的增殖能力和分化潜力,同时通过恢复肠道屏障功能和抑制炎症有效改善DSS诱导的小鼠UC。强调了CD146+iMSC作为炎症性肠病基于细胞的治疗策略的前景,值得进一步研究其临床转化潜力。
什么是溃疡性结肠炎
溃疡性结肠炎(UC)是一种慢性、复发性肠道炎症性疾病,其特征是粘膜层的慢性炎症和溃疡,通常表现为发作和缓解的交替期。UC主要发生在暴露于特定环境触发因素后的遗传易感个体中,UC的病理生理学非常复杂,肠道微生物群失调、肠上皮屏障功能障碍和免疫反应失调等因素在其发病和进展中起着至关重要的作用。在过去的二十年里,UC已成为一项全球健康挑战,其在低收入和中等收入国家的发生率急剧上升。
传统药物疗法常面临疗效有限、副作用或耐药性等挑战,对于医学上难治性UC患者,手术干预仍然是一种必要的选择,尽管术后狭窄等严重并发症会严重损害生活质量。间充质干细胞(MSCs)因其强大的免疫调节和组织修复能力,成为UC细胞疗法的重要候选者。然而,MSCs来源的异质性、培养扩增中的功能耗竭以及治疗效果的不稳定,阻碍了其广泛应用。
干细胞特性
诱导多能干细胞衍生的间充质干细胞(iMSCs)与传统的MSCs相比表现出优越的干细胞特性,CD146+MSCs表现出增强的生物学特性。
01优越的生物学特性
高纯度与稳定性:通过CD146分选获得的iPSC-MSCs亚群,具有更高的纯度和更一致的生物学特征。
强大的增殖与克隆形成能力:相比未筛选的iPSC-MSCs或传统来源的MSCs(如骨髓MSCs),CD146+亚群展现更强的自我更新和增殖潜力。
显著的免疫调节潜能:体外实验证实,iPSC-CD146+MSCs能更有效地抑制促炎细胞因子(如TNF-α, IL-6, IFN-γ)的产生,同时促进抗炎因子(如IL-10)的表达。它们显著抑制了T淋巴细胞的异常活化与增殖,尤其是Th1和Th17细胞。
增强的迁移与归巢能力: CD146分子本身参与细胞迁移和血管黏附。研究显示,该亚群在体内表现出更强的向炎症肠组织归巢的能力。
02显著的体内治疗效果
临床症状显著改善:有效减轻小鼠体重下降、腹泻、便血等症状,疾病活动指数(DAI)明显降低。
肠道炎症明显缓解:结肠组织病理学检查显示,iPSC-CD146+MSCs治疗组小鼠结肠粘膜损伤显著减轻,炎症细胞浸润减少,隐窝结构破坏得到修复,结肠长度缩短的程度也明显改善(相比对照组或非CD146+组)。
肠道屏障功能增强:治疗促进了肠上皮紧密连接蛋白的表达,有助于恢复受损的肠道屏障完整性。
03肝细胞生长因子(HGF)介导
机制研究表明,iPSC-CD146+MSCs分泌高水平的肝细胞生长因子(HGF)是其发挥强大治疗作用的关键所在。
阻断HGF后,iPSC-CD146+MSCs的治疗效果显著减弱, 证实了HGF的核心作用。
HGF通过激活其受体c-Met下游的信号通路(如AKT, ERK, STAT3),发挥多重保护效应:
抑制NF-κB信号通路:有效抑制促炎因子的产生和释放。
促进上皮细胞修复:刺激肠上皮细胞增殖和迁移,加速溃疡愈合。
保护肠上皮屏障:稳定紧密连接结构。
结 语
中国科研团队在《Stem Cell Research & Therapy》发表的这项研究,有力证明了iPSC来源并经过CD146富集的间充质干细胞(iPSC-CD146+MSCs)是一个极具前景的溃疡性结肠炎治疗新策略。其独特的生物学优势、卓越的体内疗效以及清晰的HGF核心作用机制,标志着干细胞治疗UC领域迈出了关键一步。未来需要进一步开展更大规模的动物实验和严格规范的临床试验,以评估其长期安全性和有效性,推动这一创新疗法早日惠及患者。
参考文献
1:Therapeutic evaluation of iPSC-derived CD146+ mesenchymal stem cells in ulcerative colitis: biological properties and potential mechanisms
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

