
CAR-T细胞疗法被誉为癌症治疗的“革命性武器”,它通过改造患者自身的免疫细胞来精准猎杀癌细胞。然而,一个令人沮丧的现实是:这种疗法在老年患者中的效果往往大打折扣。为什么这些“抗癌战士”在年长患者体内会“消极怠工”甚至“罢工”?
瑞士洛桑大学团队在顶级期刊《Nature Cancer》上发表的名为《Age-associated nicotinamide adenine dinucleotide decline drives CAR-T cell failure》最新研究,首次揭开了这一谜团的关键机制——与衰老相关的“能量货币”NAD(烟酰胺腺嘌呤二核苷酸)水平下降,并提出了潜在的“加油”策略。

研 究
基于嵌合抗原受体(CAR)T细胞过继细胞转移(ACT)的免疫疗法目前是治疗癌症最颇具前景的方法之一。在决定CAR-T细胞疗法成功反应的特征中,长期维持具有干细胞特性的T细胞库至关重要。研究表明,线粒体功能减弱的CAR-T细胞产品与疗效不佳相关,而通过代谢干预促进线粒体代谢能够提升CAR-T细胞疗法在临床前模型中的疗效。
衰老是与癌症相关的第一个危险因素。因此,大多数(约75%)癌症患者和有资格接受癌症免疫疗法的患者>65 岁。重要的是,在CAR-T细胞治疗的背景下,当诊断年龄中位数<20岁时,B细胞急性淋巴细胞白血病(B-ALL)的反应最高 而反应随着24岁的增加而下降。
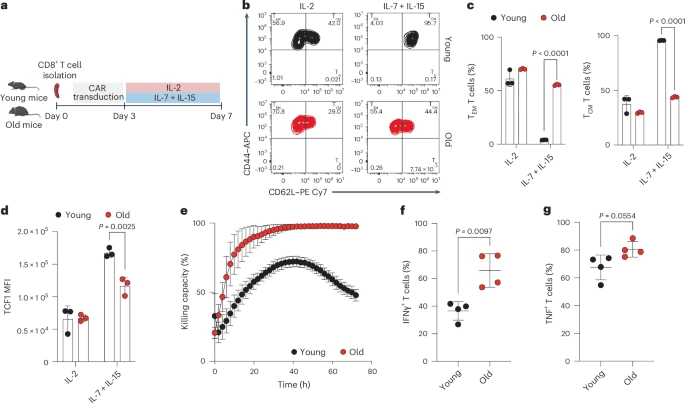
研究人员用针对人类癌基因人表皮生长因子受体2(HER2,也称为ERBB2)的Thy1.1+CAR构建体转导了来自年轻(8周龄)和老年(>80周龄)小鼠的CD8+T细胞(参考文献13,14,30)。然后在效应样(TEM)或记忆样(TCM)极化条件下扩增CAR-T细胞(分别使用白细胞介素2(IL-2)或IL-7和IL-15)(图1a)。从年轻和老年小鼠中分离出CD8+幼稚T细胞(CD44−CD62L+),并在体外测试了它们的分化能力。在初始激活后,我们在TEM或TCM极化条件下扩增,我们观察到来自老年小鼠的幼稚T细胞不能有效地向TCM表型分化(扩展数据图1b)。
结果表明,在老年CAR-T细胞输注产品中发现的有缺陷的记忆样表型不仅是因为初始群体异质性的差异,还因为CD8+T细胞的细胞内在缺陷。
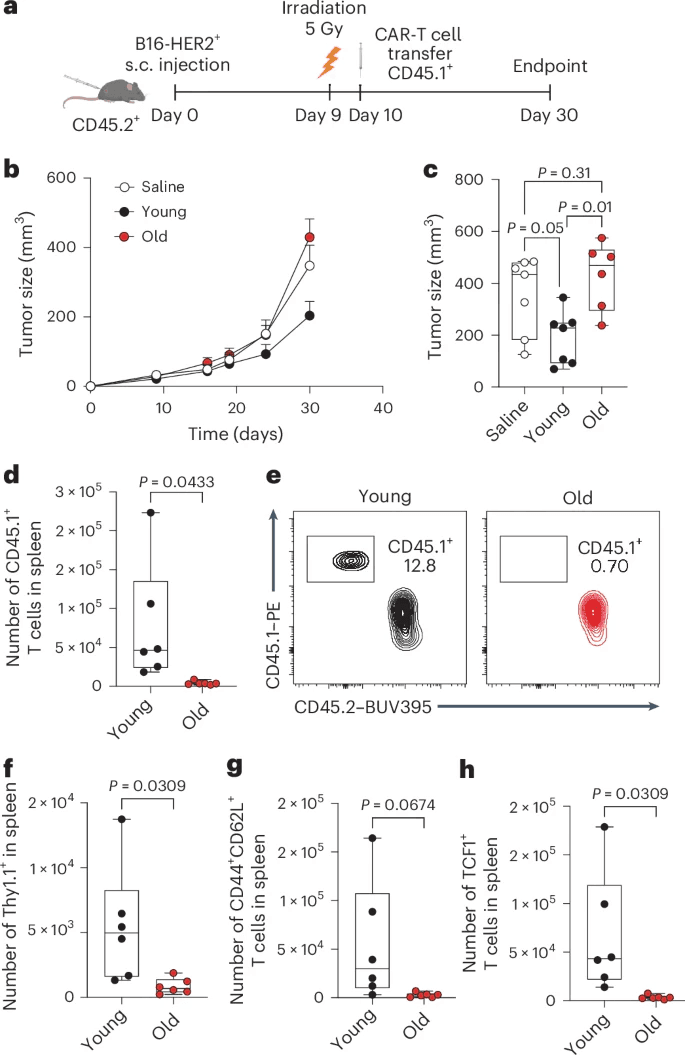
将年轻和年老的CAR-T细胞(CD45.1+)过继转移到携带HER2+B16肿瘤的小鼠(CD45.2+)体内。我们观察到,只有来源于年轻小鼠并用IL-7和IL-15扩增的CAR-T细胞,而不是来源于老年小鼠的细胞,可以控制肿瘤生长(图2b,c)。在IL-2中扩增时,年轻和老年CAR-T细胞之间没有观察到差异(扩展数据图1m)。年轻的CAR-T细胞能够在体内长期存活,在脾脏中产生CD44+CD62L+TCF1+CAR-T细胞池,这些细胞有可能产生可迁移到肿瘤微环境(TME)的肿瘤特异性TEM细胞。转移的(CD45.1+)和表达CAR的(Thy1.1+)衰老T细胞的数量几乎无法检测到30 脾脏中ACT后几天(图2d-f)。衰老的CAR-T细胞完全缺乏记忆或干细胞表型,如CD44+CD62L+(图2g)或TCF1+T细胞(图2h)的缺失所示,这突显了它们在体内的持续能力较差,这与它们的TEM承诺是一致的。
在T细胞受体刺激下,旧CD8+T细胞显示出基础和最大耗氧率(OCR)降低(扩展数据图3b,c)。为了证明这些线粒体缺陷是由衰老引起的细胞固有缺陷,我们证明线粒体活性在所有T细胞群(幼稚T细胞(TN)、TEM和TCM)中都受到抑制(扩展数据图3d,e)。同样,幼稚CD8+T细胞也表现出线粒体活性的年龄依赖性逐渐降低,而不改变线粒体大小(扩展数据图3f-h)。电子显微镜(EM)证实了这些发现,因为线粒体的数量或大小没有差异(图3c,d),但衰老的幼稚CD8+T细胞的嵴数量减少(图3c、e),这是线粒体活性降低的一个特征。
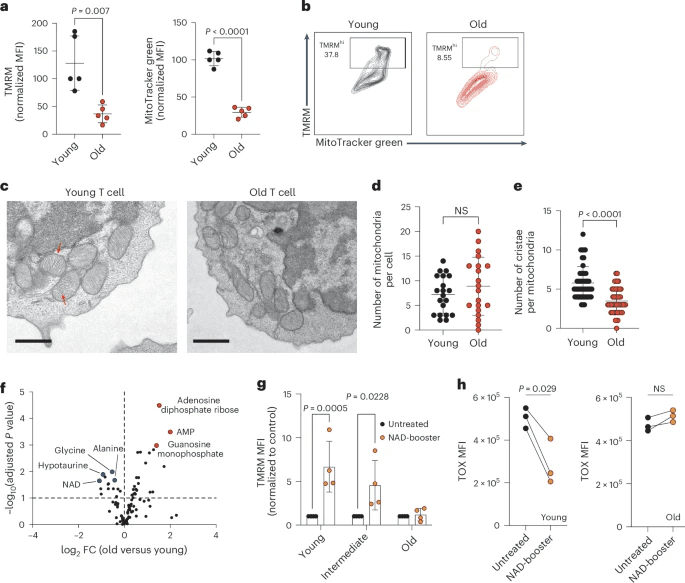
研究结果表明,衰老的CD8+T细胞积累了与NAD下降相关的重要线粒体缺陷,这无法通过常规NAD前体的给药来逆转。衰老过程中WAT、肌肉和肝脏中NAD下降的主要触发因素之一是CD38的系统性上调(参考文献27)。CD38是一种多功能酶,可降解NAD并调节多种免疫细胞中的NAD稳态。
在衰老的CD8+T细胞中,只有CD38hi T细胞显示出线粒体活性降低,而在年轻的对照组中则没有(图4b,c)。此外,用CD38过表达构建体转导的年轻CD8+T细胞表现出有限代的TCM细胞和线粒体DNA(mtDNA)含量降低(扩展数据图4b,c),概括了老年CD8+T细胞的特征。这些结果表明,CD38可以调节CD8+T细胞的线粒体活性和命运决定,在CD38、衰老、线粒体健康和T细胞干度维持之间建立联系。
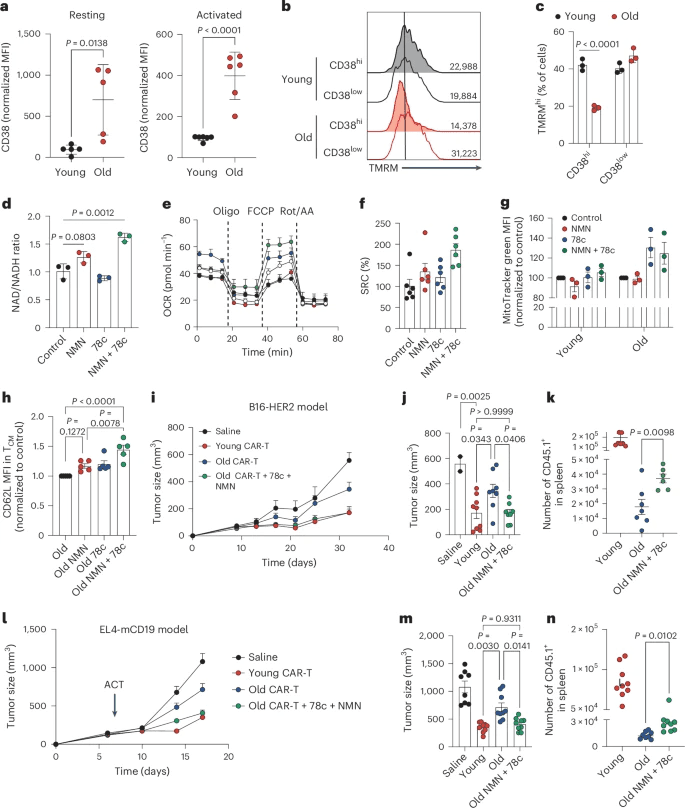
这些数据表明,在衰老过程中受到极大损害的NAD代谢是CAR-T细胞成功反应的关键决定因素。提高NAD水平的联合策略,如NAD前体与CD38或PARP抑制剂,可以使衰老的CAR-T细胞恢复活力,最终提高治疗效果。
研究人员对20名LBCL(10 R和10 NoR)参与者的基线外周血单核细胞(PBMCs)的单细胞转录组分析显示,R和NoR参与者的CD8+T细胞的NAD代谢特征存在差异(图5b和扩展数据图7a)。这些差异也在自然杀伤(NK)细胞中检测到,但在其他免疫细胞中没有检测到(扩展数据图7b)。
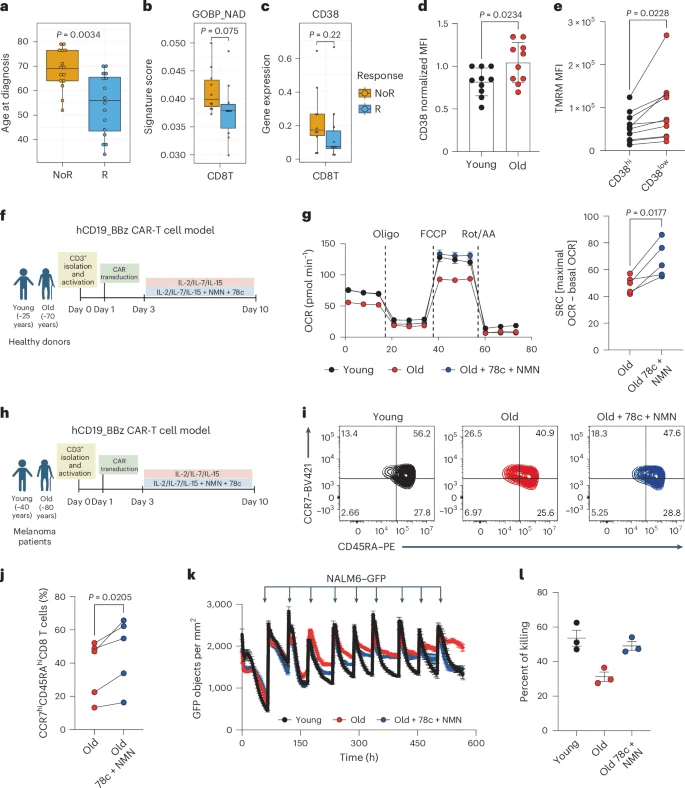
在71名B-ALL参与者的50个预制T细胞中,几种T细胞亚型中Cd38基线水平的增加抑制了CAR-T细胞在输注后的持久性(扩展数据图6e),这表明Cd38与CAR-T细胞的干性潜力有关。
数据表明,年龄依赖性的NAD下降导致T细胞线粒体缺陷和干细胞样特性的丧失,最终导致CAR-T细胞衰竭。此外,我们将恢复NAD细胞水平作为在衰老背景下恢复线粒体功能和恢复CAR-T细胞活力的策略。
衰老患者的困境:CAR-T疗效为何“缩水”?
CAR-T疗法在某些血液肿瘤中取得了显著成功,但其疗效在不同患者群体中存在巨大差异。临床观察表明,老年患者接受CAR-T治疗后的缓解率和长期生存率往往低于年轻患者。这种“年龄歧视”现象背后的生物学原因一直困扰着科学家和临床医生。
NAD下降——CAR-T“能量危机”的导火索
洛桑大学的研究团队通过深入分析患者样本和构建衰老模型,取得了突破性发现:
1.“燃料”告急:他们首次证实,衰老个体的血液和组织中,关键的辅酶和代谢物NAD+水平显著下降。NAD+是细胞能量代谢(尤其是线粒体功能)的核心参与者,被誉为细胞的“能量货币”。
2. 引擎”故障:当CAR-T细胞被输入到这种NAD+匮乏的衰老微环境中时,它们自身也出现了严重的NAD+缺乏。这直接导致了CAR-T细胞的线粒体功能障碍。线粒体是细胞的“动力工厂”,其功能受损意味着CAR-T细胞无法高效产生能量(ATP)。
3.“战士”失能:能量危机带来了更严重的后果。研究发现,NAD+缺乏的CAR-T细胞丧失了关键的“干细胞样特性”。这种特性是CAR-T细胞能够持续增殖、长期存活并在体内持续对抗癌细胞的基础。失去它,CAR-T细胞就变成了“一次性”的短命战士,无法形成持久的抗癌战斗力。
4.“罢工”结局:线粒体功能紊乱和干细胞特性丧失的最终结果,就是CAR-T细胞在体内的扩增能力减弱、持久性下降、抗肿瘤效力显著降低——这就是它们在老年患者体内“罢工”的分子基础。
关键机制链条
患者衰老 → NAD+水平下降 → 输注的CAR-T细胞NAD+缺乏 → CAR-T细胞线粒体功能障碍 + 干细胞样特性丧失 → CAR-T细胞扩增/持久性/杀伤力下降(治疗失败)
针对性“加油”策略或能重启CAR-T
这项研究的价值不仅在于揭示了问题根源,更在于提出了潜在的解决方案:
01补充燃料
研究人员尝试在体外或体内给CAR-T细胞补充NAD+的前体物质(如烟酰胺核苷酸NR)。令人振奋的是,这种干预显著提升了老年模型(小鼠)中CAR-T细胞的NAD+水平。
02引擎修复
补充NAD+前体有效逆转了CAR-T细胞的线粒体功能障碍,让“动力工厂”重新高效运转。
03战士重生
更重要的是,补充NAD+前体成功恢复或增强了CAR-T细胞的干细胞样特性。
04战力飙升
最终,在老年小鼠模型中,经过NAD+前体“加持”的CAR-T细胞,其体内扩增能力、持久性和抗肿瘤效果都得到了显著提升,甚至接近了年轻模型中的水平!研究显示,补充NR的老年小鼠CAR-T疗效提升幅度可达70%以上(相比未补充的老年组)。
结 语
瑞士洛桑大学的这项研究,像一盏明灯照亮了CAR-T疗法在老年患者中失效的“黑暗地带”。它揭示出衰老导致的“能量货币”NAD+匮乏,是迫使这些抗癌精锐部队“罢工”的深层原因。而通过针对性补充NAD+前体这一相对简单的策略,科学家们成功地在实验模型中“重启”了CAR-T细胞的战斗力。这为未来开发更有效的、惠及老年癌症患者的免疫治疗方案带来了充满希望的曙光。下一步,将是在临床试验中验证这一策略的安全性和有效性,让科学发现真正转化为挽救生命的力量。
参考文献
1:《Nature Cancer》和研究机构(瑞士洛桑大学)
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

