
当化疗、靶向治疗相继失效,晚期胰腺癌患者终于迎来破局希望——北京医院团队最新临床研究显示,经工程化改造的NK细胞联合疗法,让近1/3患者肿瘤显著缩小,改写“癌王”无药可治的绝望困局。
11月21日,北京医院马洁/赵云博/肖飞团队在《信号转导与靶向治疗》 (Signal Transduction and Targeted Therapy,IF=52.7)发表的一项1b/2期临床试验结果显示:NK细胞联合治疗使31.6%的晚期胰腺癌患者肿瘤显著缩小,疾病控制率达到73.7%。

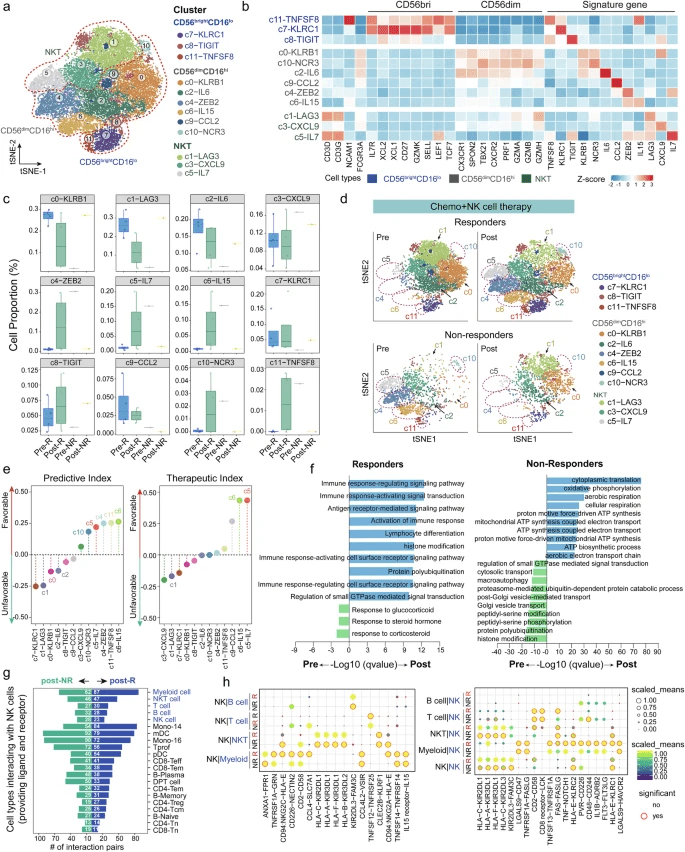
研究团队向24名患者输注1×10^9至8×10^9个自然杀伤(NK)细胞后,患者耐受性良好,未出现移植物抗宿主病或剂量限制性毒性。在19例可评估患者中,客观缓解率为31.6%,疾病控制率为73.7%。中位无进展生存期为6.6个月,总生存期为10.8个月。对19例配对血液样本进行纵向单细胞RNA测序(scRNA-seq)分析显示,缓解组中特定NK细胞亚群(c4-ZEB2、c5-IL7、c6-IL15、c10-NCR3和c11-TNFSF8)及T细胞亚群(CD8+效应T细胞和CD4+记忆T细胞)比例升高,其特征为促炎和效应分子表达增强。
患者按照剂量递增设计接受活化的同种异体NK细胞(图1a)。每个治疗周期包括第1至14天的标准GS化疗,然后在第14至21天之间输注一次同种异体NK细胞。患者计划接受6至8个周期的GS化疗,然后进行S-1维持,在前四个周期内给予NK细胞。表达强烈希望在四个周期后继续进行NK细胞治疗的患者有资格接受同情治疗,治疗周期频率由研究人员根据个体耐受性和反应确定(图1b)。
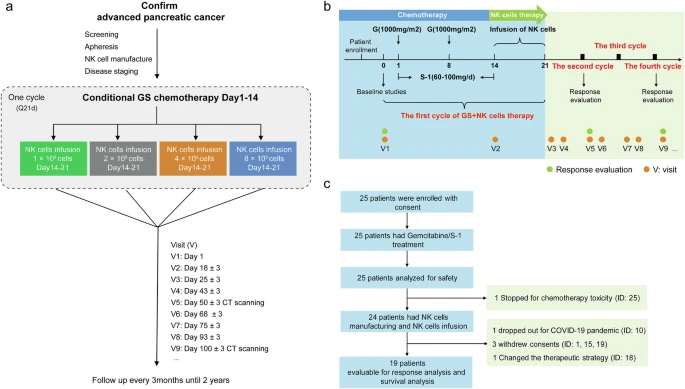
从2019年3月8日到2022年9月16日,25名患者签署了知情同意书,并随访至2023年7月30日。在这25名患者中,24名患者接受了NK细胞输注治疗(1名患者因严重化疗毒性而退出治疗),19名患者进行了反应分析和生存评估(1例患者因新冠肺炎大流行而退出治疗,4名患者在病情缓解前撤回同意或改变治疗策略)(图1c)。每位患者的研究时间和临床试验结束后的随访时间(自入组以来的生存率,n = 24)
中位年龄为64岁(44-75岁),80.0%(20/25)的患者为男性。3名患者(12.0%)患有局部晚期胰腺癌癌症(LAPC),22名患者(88.0%)患有转移性癌症(MPC),32.0%(8/25)的患者至少有三个转移部位。24名(96.0%)患者接受了至少一个周期的基于NK细胞的治疗,其中9名患者输注了外周血(PB)衍生的NK细胞,15名患者输入了脐带血(CB)衍生的NK细胞。所有同种异体NK细胞产品均符合预定义的释放标准,PB和CB衍生的NK细胞产品在纯度、存活率或细胞毒性方面没有显著差异。
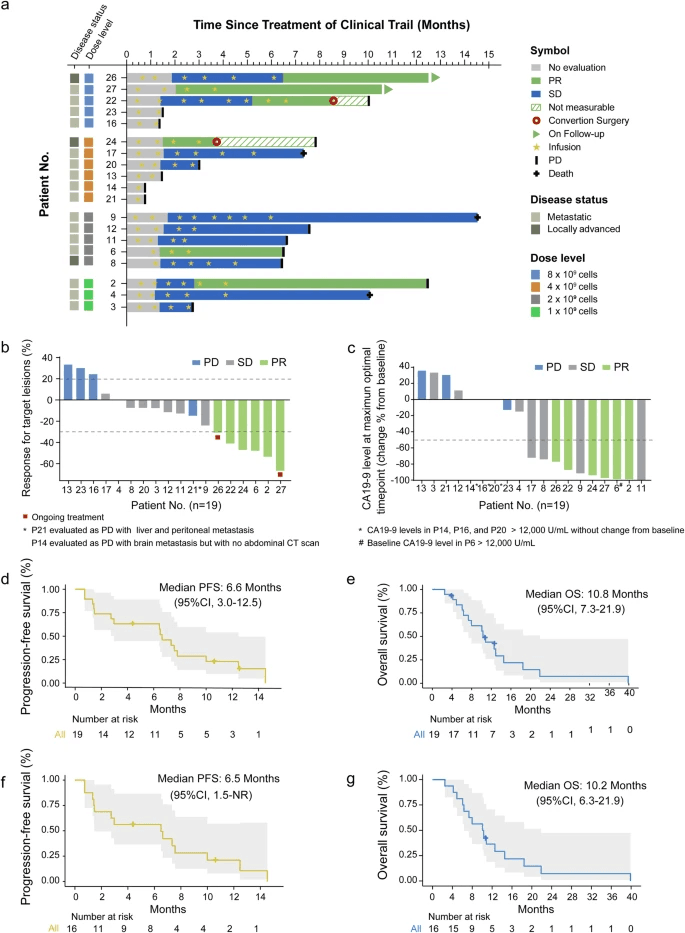
对19名APC患者进行了临床反应评估,中位随访期为17.7个月(范围2.5-39.9)。每个人的NK细胞输注周期的中位数为4,范围在1-13之间。在所有四个剂量递增队列中,6名患者(31.6%)达到部分缓解(PR),8名患者(42.1%)达到疾病稳定(SD)(图2a、表3和补充表4)。18名受试者有可测量的基线后靶病变;其中,13名患者(72.2%)出现了肿瘤消退(图2b)。客观缓解率(ORR)和疾病控制率(DCR)分别为31.6%(95%置信区间,12.6-56.6)和73.7%(95%置信范围,48.8-90.9)(表3)。19名接受治疗的受试者中有10名(52.6%)的CA19-9含量下降了至少50%,这与PR和SD患者CA19-9浓度下降的观察结果一致(图2c)。中位无进展生存期(mPFS)和中位总生存期(mOS)分别达到6.6个月(95%CI,3.0-12.5)和10.8个月(95%CI,7.3-21.9)(图2d、e和表3)
在所有APC患者中,循环T/NK细胞和CD14+单核细胞的数量相对较高(图3e)。
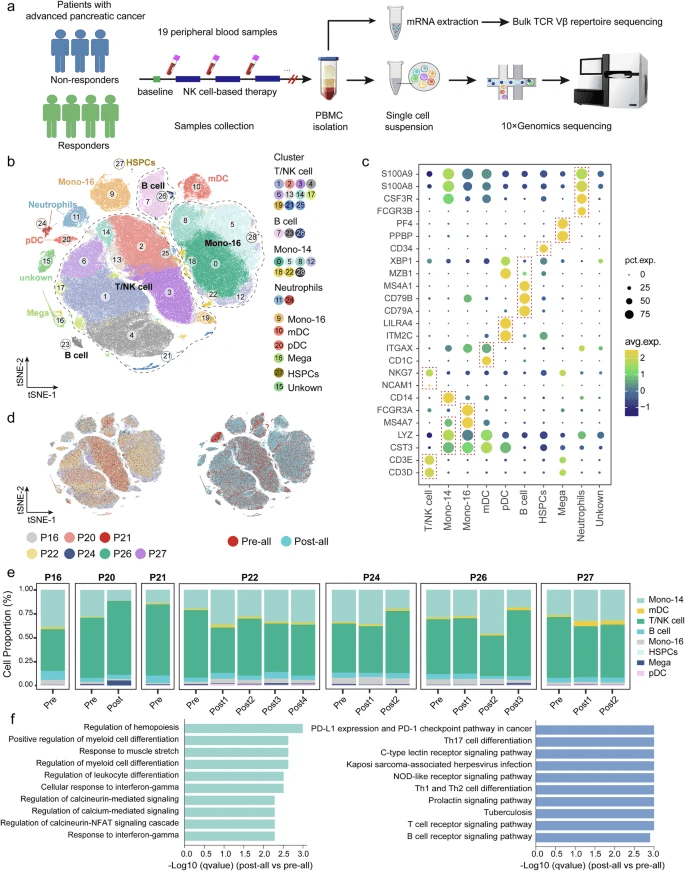
基因集富集分析(GSEA)显示,治疗后患者样本中与炎症反应和促炎细胞因子相关的标志性途径显著富集(补充图4d)。这些结果表明,APC患者在接受基于NK细胞的治疗后表现出增强的整体外周免疫反应。
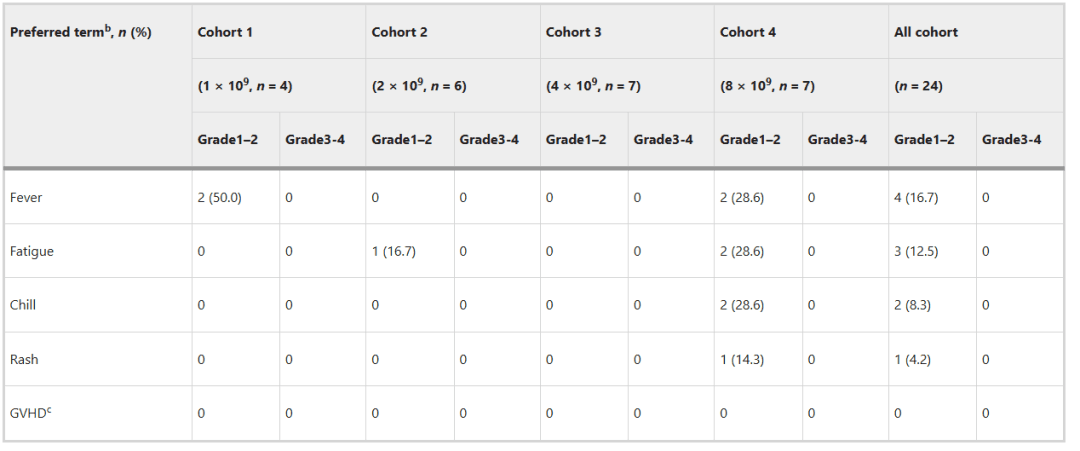
研究结果显示:所有DL患者对NK细胞的给药都具有良好的耐受性,并且没有达到最大耐受剂量(MTD)。未报告导致停药的DLT或治疗相关严重不良事件(AE)。高级血液学和胃肠道毒性主要与条件性GS化疗有关。所有与NK细胞相关的不良事件均在2级以内;其中,发烧、疲劳和发冷最常见于输注后几个小时内。此外,尽管同种异体NK细胞产物和受体的HLA存在差异,但未检测到GVHD,这与之前关于NK细胞治疗几种血液系统和实体恶性肿瘤的报告一致。
这项异基因NK细胞治疗联合GS在APC患者中的1b/2期临床试验证明了其安全性和初步疗效,值得进一步进行更大规模、前瞻性、随机对照试验。异基因NK细胞与其他已建立的方案(如FOLFIRINOX或吉西他滨/nab紫杉醇)联合使用,可能会扩大全球治疗的适用性。此外,研究确定了与APC中循环NK和T细胞亚群相关的潜在临床结果,为外周免疫环境的动态转录基础提供了新的见解,对基于NK细胞的治疗有不同的反应。这些全面的动态转录组和TCR序列为破译其他实体瘤中NK细胞治疗后免疫细胞的功能状态和动力学提供了宝贵的资源。
首次证实了 NK细胞联合吉西他滨+ S-1 化疗治疗晚期胰腺癌的安全性和初步疗效,还找到了能预测治疗效果的免疫细胞标志物,为后续精准免疫治疗提供了方向。
癌症免疫疗法的最新进展彻底改变了癌症治疗的格局,免疫检查点抑制剂(ICIs)通过重振T细胞介导的抗肿瘤反应,在多种恶性肿瘤中表现出显著的疗效。然而,ICIs治疗PC的有效性仍然令人失望,因为免疫抑制肿瘤微环境(TME)以密集的基质屏障和功能失调的内源性T细胞为特征,使ICIs在很大程度上无效。这些治疗挑战激发了人们对PC中免疫检查点抑制剂以外的替代策略的兴趣,其中基于自然杀伤(NK)细胞的治疗已成为有前景的选择。
胰腺癌是恶性程度最高的肿瘤之一,早期症状隐匿,超过90%的患者确诊时已失去手术根治机会。 晚期胰腺癌的治疗以全身性化疗为主,吉西他滨联合S-1(GS方案)是亚洲人群的一线选择,但疗效不甚理想,患者长期生存仍面临严峻挑战。 免疫检查点抑制剂在多种癌症中效果显著,但在胰腺癌中却收效甚微,主要原因是胰腺癌的肿瘤微环境具有极强的免疫抑制性,如同为肿瘤穿上“保护罩”,使免疫治疗难以发挥作用
NK细胞(自然杀伤细胞)
NK细胞(自然杀伤细胞)作为先天免疫系统的核心效应细胞,在胰腺癌治疗中展现出独特的抗肿瘤机制,其作用主要通过以下环节实现:
1免疫监视与快速响应
NK细胞通过表面活化受体(如NKG2D)识别癌细胞表达的应激蛋白(如MICA/B),同时依赖抑制性受体(如KIR)与正常细胞表面的MHC-I分子结合以避免误伤。胰腺癌细胞常通过下调MHC-I逃避免疫攻击,这一特征反而激活NK细胞的杀伤活性。
穿孔素/颗粒酶途径:NK细胞释放穿孔素在癌细胞膜形成孔洞,颗粒酶进入细胞后激活凋亡信号通路,诱导程序性死亡。
死亡受体途径:通过Fas配体(FasL)或肿瘤坏死因子相关凋亡诱导配体(TRAIL)与癌细胞表面受体结合,触发细胞凋亡。
抗体依赖的细胞介导的细胞毒性(ADCC):NK细胞通过Fc受体结合肿瘤特异性抗体(如抗CEA单抗),增强对胰腺癌细胞的靶向杀伤。
2免疫调节与微环境重塑
NK细胞分泌干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)等细胞因子,抑制肿瘤血管生成,并激活树突状细胞和T细胞,形成“先天免疫-适应性免疫”协同效应。例如,在临床研究中,响应NK细胞治疗的患者体内强效NK细胞亚群(如c4-ZEB2、c10-NCR3)扩增,同时CD8+效应T细胞活性增强,提示NK细胞可重塑免疫抑制微环境。
研究团队透露:国产自动化细胞生产系统已进入验证阶段,尽管NK细胞联合治疗展现出有前景的抗肿瘤效果,但仍有部分患者出现复发,提示需要更精确的评估标准来确定手术时机和选择患者。 未来研究将聚焦于优化NK细胞输注剂量和时机,探索联合其他免疫治疗手段的可能性,以及开发基于生物标志物的个体化治疗方案。
结 语
北京医院马洁/赵云博/肖飞团队的这项研究,不仅为晚期胰腺癌患者带来了新的希望,也为免疫治疗在实体瘤中的应用开辟了新的道路。NK细胞联合治疗的成功,标志着胰腺癌治疗从传统化疗向精准免疫治疗迈出了重要一步。随着研究的深入,我们期待这一疗法能够为更多晚期胰腺癌患者带来长期生存的曙光。
参考文献
1:Dynamic transcriptional immune landscape in response to NK-cell therapy combined with gemcitabine plus S-1 in advanced pancreatic cancer: a phase 1b/2 trial
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

