
华中科技大学团队在肝病学顶刊《Hepatology》发表的突破性研究题为“Short-term starvation boosts anti-PD-L1 therapy by reshaping tumor-associated macrophages in hepatocellular carcinoma”的研究论文揭示:短期饥饿可重塑肿瘤微环境,将免疫细胞从“帮凶”转化为“抗癌战士”。这一发现为“饿死癌细胞”提供了全新科学解释。

饮食干预诱导的肿瘤微环境改变(TME)被描述为癌症的一个关键标志。新出现的证据表明,饮食改变,如周期性饥饿、热量限制饮食、生酮饮食和低蛋白饮食,代表了抑制肿瘤生长的有前途的策略。以短期饥饿(STS)和模拟禁食饮食(FMD)为代表的能量限制(ER)方案,是目前临床实践中最受欢迎的治疗饮食。禁食增加CD8+T细胞浸润,减少免疫抑制调节T细胞或骨髓源性抑制细胞(MDSC)。此外,禁食会影响单核细胞池。总体而言,这些研究表明,饥饿方案可以重塑免疫系统。此外,在一项临床试验中,FMD被发现是安全的,并增强抗肿瘤免疫力。
大多数关于癌症饮食调节的研究都集中在淋巴细胞上。肿瘤相关巨噬细胞(TAM)是TME中最丰富的免疫细胞之一。因此,通过饮食调节重新编程TAMs在提高免疫治疗的有效性方面具有巨大的潜力。
研究人员将将Hepa1-6细胞(2×106)皮下注射到C57BL/6J小鼠、Rag2 KO小鼠和NCG小鼠的侧翼。小鼠接受STS(第8-10、13-15和18-20天)。对于严重热量限制(SCR)方案,小鼠被喂食能量减少80%的饮食5天,然后再喂食2天,2个周期(第9-14天和第16-21天)。在第9、14和19天进行抗PD-1或抗PD-L1腹膜内接种(200μg/只小鼠)。对于原位肝细胞癌模型,将Hepa1-6细胞(8×105)原位注射到小鼠肝脏左叶。HCC肿瘤在治疗前允许生长11天。
接下来,小鼠在2天的3个周期(第12-14天、第17-19天和第22-24天)内完全禁食,自由饮水。在第13、18和23天通过腹腔注射给予抗PD-1或抗PD-L1(每只小鼠200μg/只)
通过腹腔注射Clophosome Clodronate脂质体或同种型(对照脂质体)(F70101C-N,FormuMax)进行巨噬细胞的耗竭。在第一次注射期间,给予1.4mg,然后每4天给予0.7mg,持续4个周期。通过每4天腹腔注射200μg抗小鼠CD8α(BE0004-1,克隆53-6.7,BioXCell)进行4个周期的CD8+T细胞耗竭。所有耗竭试验均在6周龄的C57BL/6J小鼠中进行。
在皮下HCC模型中测试了对STS或SCR的反应(图1A、B)。STS方案改编自之前报道的策略。2 SCR是通过间歇性饮食限制实现的,同时允许自由饮水,类似于FMD方案。7 STS在抑制肿瘤生长和延长生存期方面显示出更大的疗效(图1C、D;补充图S1A、B、C).每次禁食后体重减轻;然而,重新喂食后体重又恢复了。此外,肿瘤生长的减少不是由体重过度减轻(>20%的体重)引起的(图1E)。
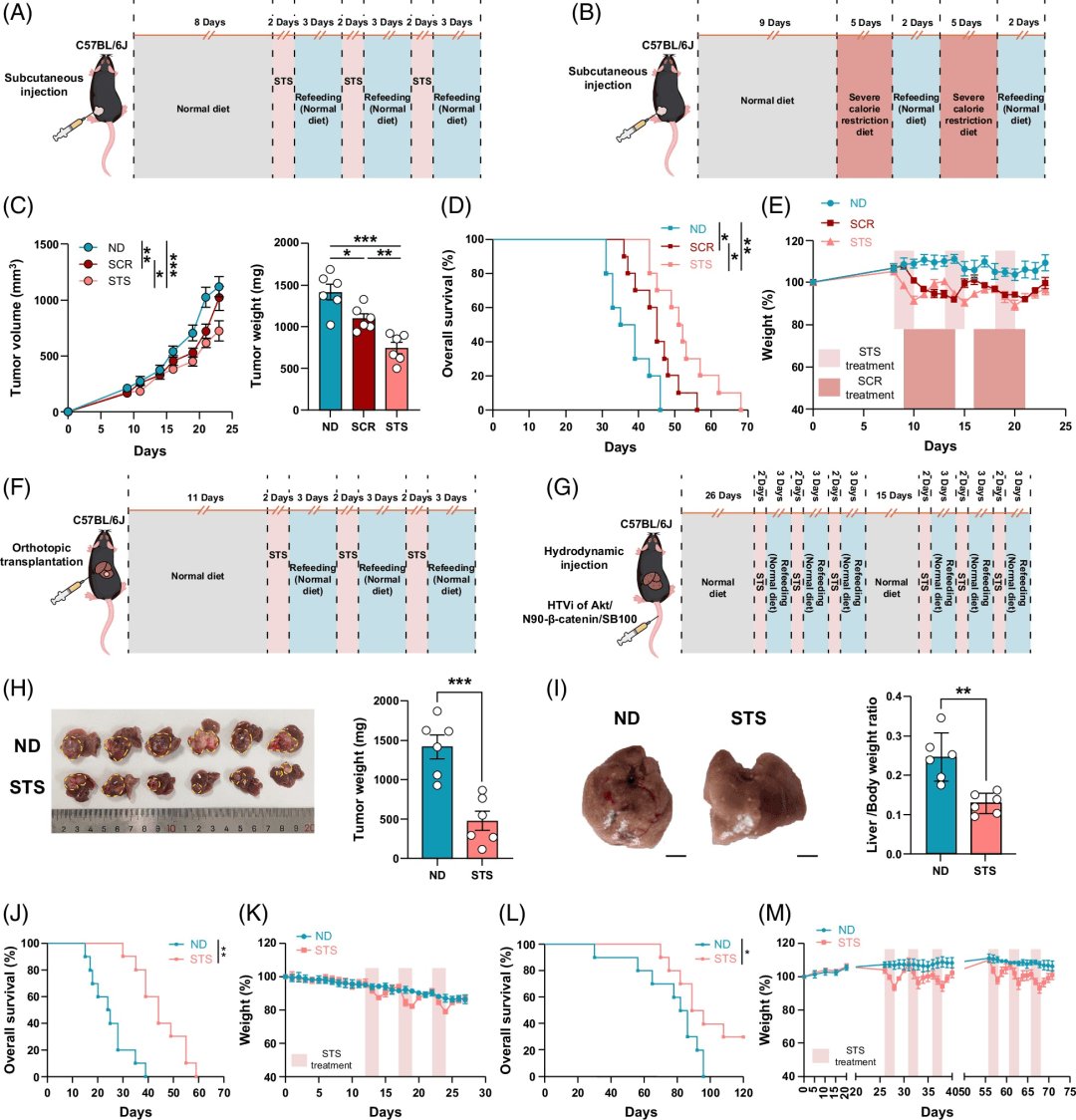
实验在原位和流体动力学HCC小鼠模型中进一步测试了STS(图1F,G)。鉴于流体动力学HCC模型需要更长的时间来形成肿瘤,我们额外进行了三个STS周期(图1G)。STS在两种HCC模型中均持续减小肿瘤大小(图1H、I;补充图S1C、D,).STS治疗后的生存时间更长,表明STS的肿瘤减少效果是持久的(图1J,L)。STS使剩余的荷瘤小鼠在流体动力学HCC模型中存活了很长一段时间。
与SCR相比,STS方案在抑制肿瘤进展方面更有效,作为一种短期治疗,在携带HCC的小鼠中提供了安全、稳定和持久的效果。
为了确定STS是否通过直接抑制肿瘤细胞生长或调节免疫系统导致HCC消退,我们在高营养或低营养条件下培养Hepa1-6细胞,分别在体内模拟正常饮食(ND)和STS方案。将在不同营养条件下培养的肿瘤细胞移植到C57BL/6J小鼠(免疫活性)和NCG小鼠(免疫缺陷)的左侧(免疫侧)。1周后,所有小鼠右侧(幼稚肿瘤侧)接种正常培养的HCC细胞(图2A)。尽管低营养条件抑制了肿瘤细胞的迁移和增殖(补充图S3A-L),观察到肿瘤生长没有差异。这一发现表明,STS通过调节免疫系统来抑制HCC的消退。
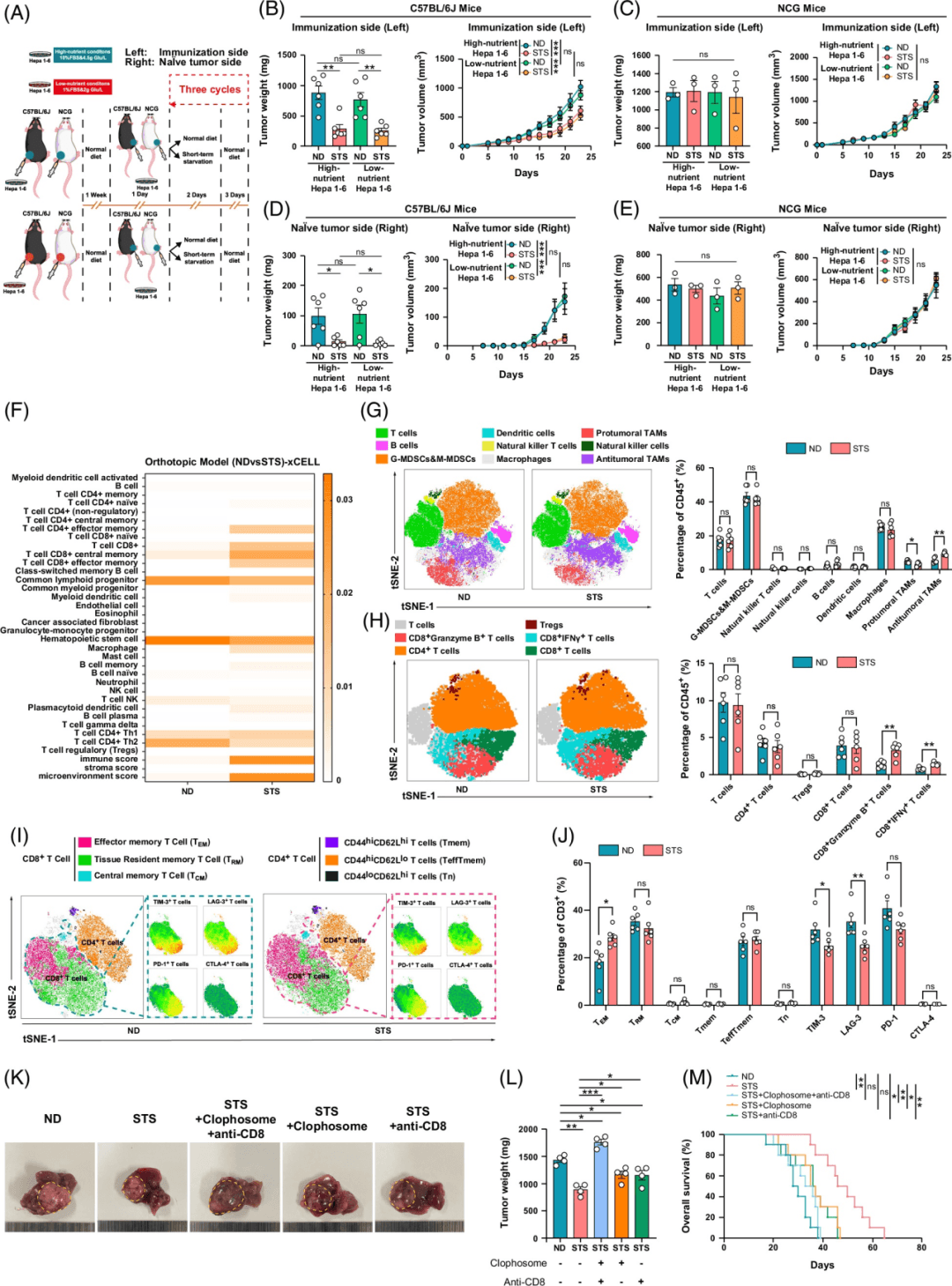
STS组的巨噬细胞和CD8+T细胞得分较高(图2F)。STS将TAM极化从pTAM改变为aTAM,而其他免疫细胞的比例没有明显变化(图2G)。原位和流体动力学HCC模型中,STS组CD8+IFNγ+T细胞和CD8+Granzyme B+T细胞(GZMB+T细胞)的比例升高(图2H;补充图S5A-E).此外,STS增加了效应记忆T细胞的频率,降低了免疫检查点分子的表达,包括T细胞免疫球蛋白和粘蛋白结构域-3(TIM-3)以及淋巴细胞活化基因-3(LAG-3)(图2I,J)。
STS降低了血液中G-MDSC和CD45+CD11hiGr1mid髓系衍生抑制细胞(M-MDSC)的数量。与所检查的其他隔室相比,STS期间BM中的G-MDSC和M-MDSC增加(补充图S6F,G)
研究结果表明,STS可以通过刺激巨噬细胞向aTAM的极化和增强CD8+T细胞功能来抑制HCC肿瘤的生长。此外,STS增强了肿瘤内的免疫记忆反应,并重新排列了全身免疫细胞池。
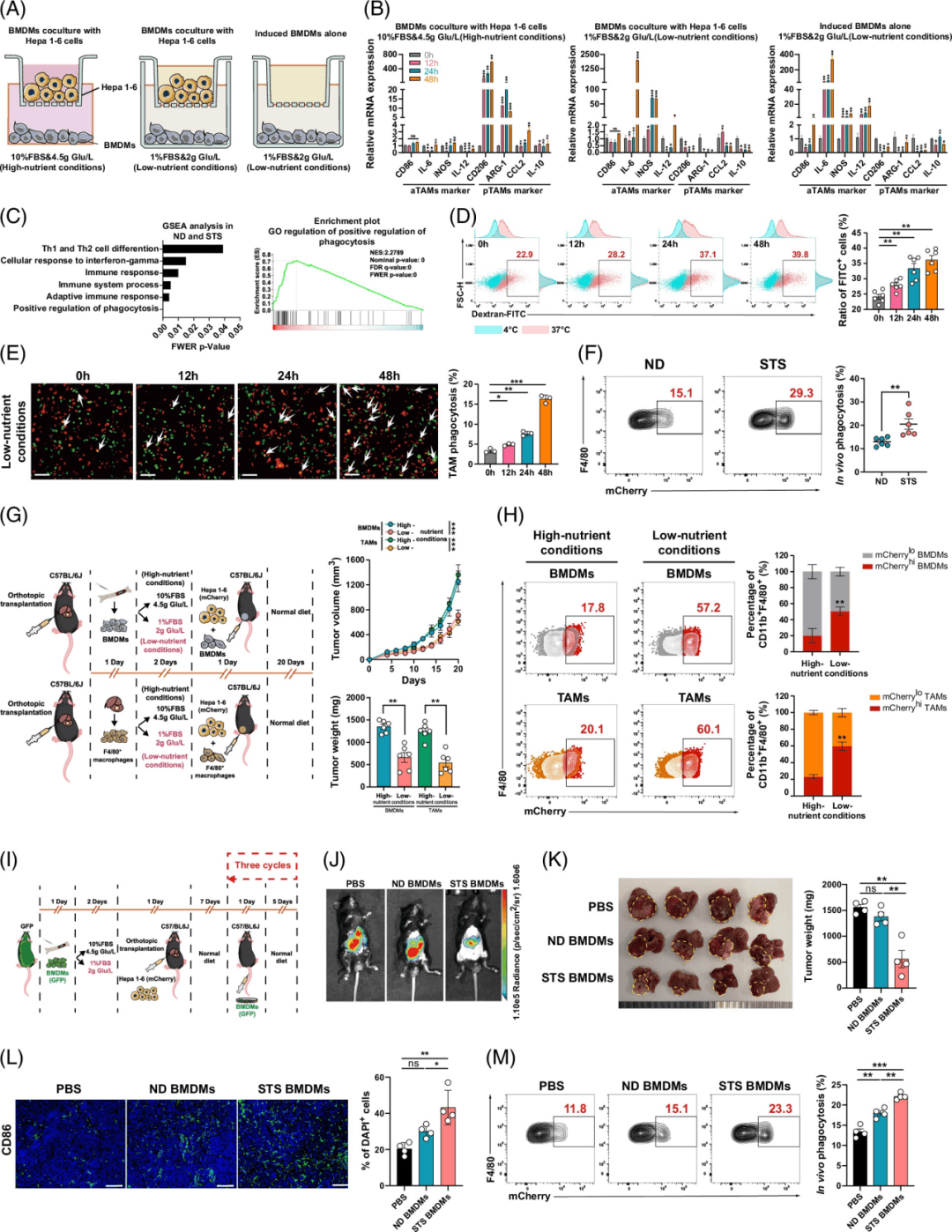
此外,在接受过继性巨噬细胞转移治疗的小鼠肝脏中观察到抗肿瘤巨噬细胞的数量增加(图3L)。值得注意的是,STS预处理的巨噬细胞的吞噬能力在体内保持完整(图3M)。Rag2−/与在高营养条件下培养的接受BMDM的小鼠相比,小鼠显示出肿瘤生长减少(补充图S10A-F).这些发现意味着饥饿加速了pTAM向aTAM的转化,并增强了它们吞噬肿瘤细胞的能力。
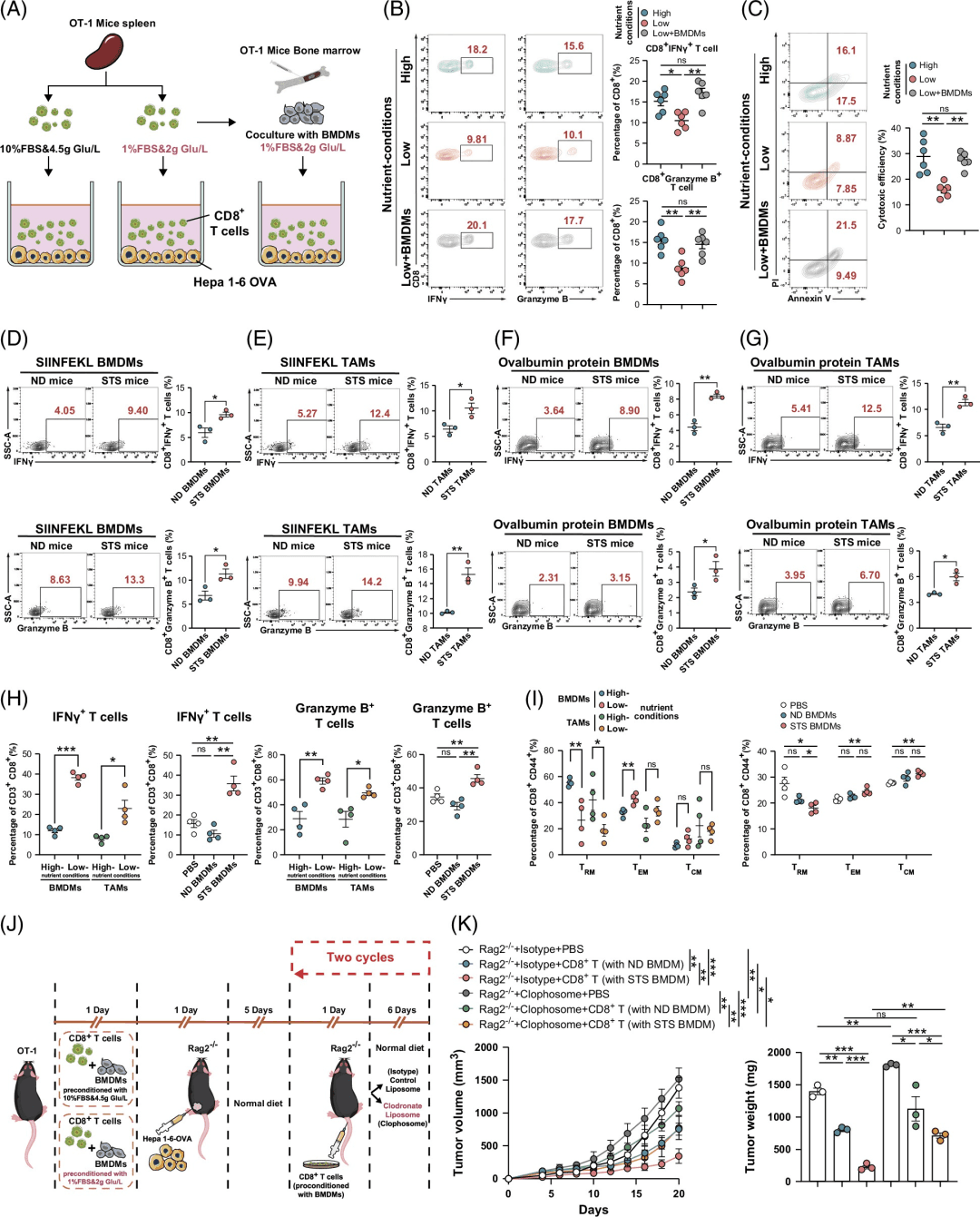
巨噬细胞可以通过分泌细胞因子或在主要组织相容性复合体I/II类上呈递肿瘤抗原来促进T细胞介导的抗肿瘤反应。33与STS条件BMDM上清液共培养的CD8+T细胞分泌更多的GZMB和IFNγ(补充图S12A、B、C和D)
为了研究饮食疗法和免疫疗法在HCC中的联合疗效,我们将小鼠分为6组,在皮下和原位HCC模型中分别给予ND、STS、抗PD-1、抗PD-L1、STS+抗PD-1或STS+反PD-L1。生存分析显示,STS联合抗PD-L1治疗具有最高疗效(图5B)
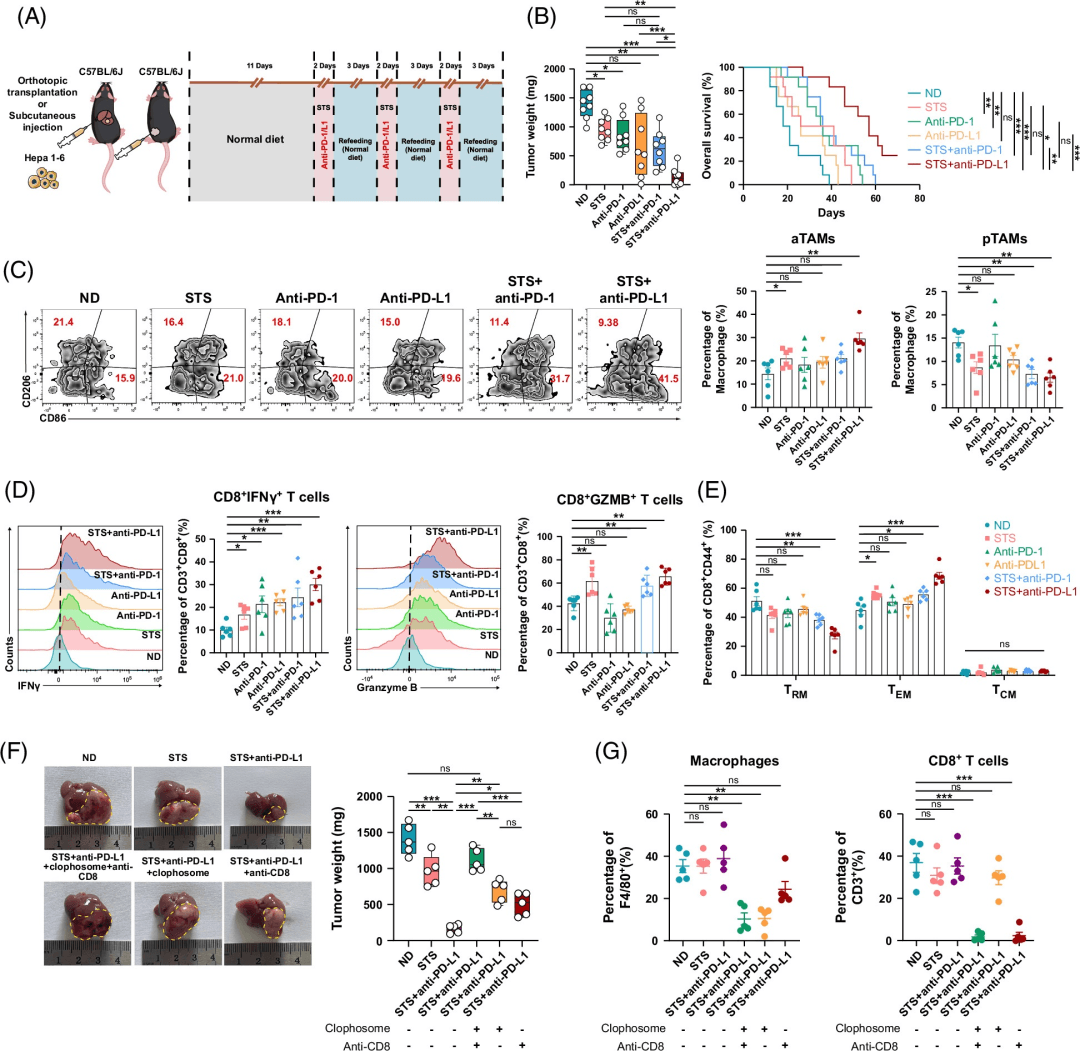
总的来说,STS和ICIs的组合对减少肿瘤生长和提高HCC肿瘤存活率具有最佳效果。组合疗法类似于单独的饥饿疗法,可以激活aTAM和CD8+T细胞杀伤功能,并提供持久的免疫记忆反应。
研究结果表明,STS增强了抗PD-1/PD-L1治疗的疗效。因此,研究了PD-1和PD-L1在原位HCC模型中的表达分布。与血液和脾脏相比,PD-1和PD-L1主要通过淋巴细胞和髓系细胞在肿瘤组织中表达(图6A、B)。此外,与其他髓系细胞相比,PD-1/PD-L1表达主要在TAM中富集(图6C、D)
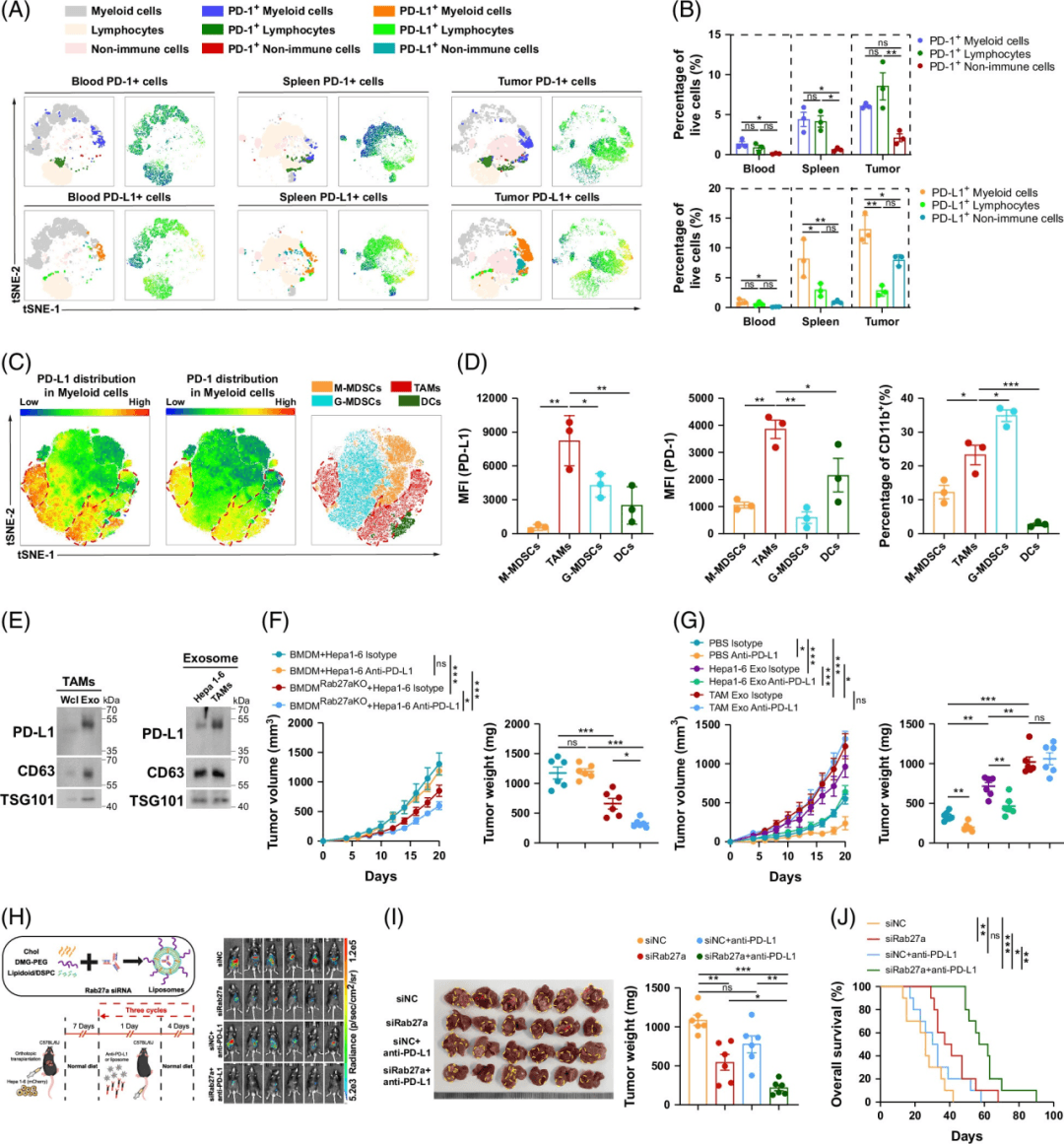
上述结果表明,PD-L1主要富集在TAMs中,TAMs是外源PD-L1的主要来源,并导致ICI抗性。抑制TAM的外泌体分泌可以提高PD-1/L1抗体的疗效。
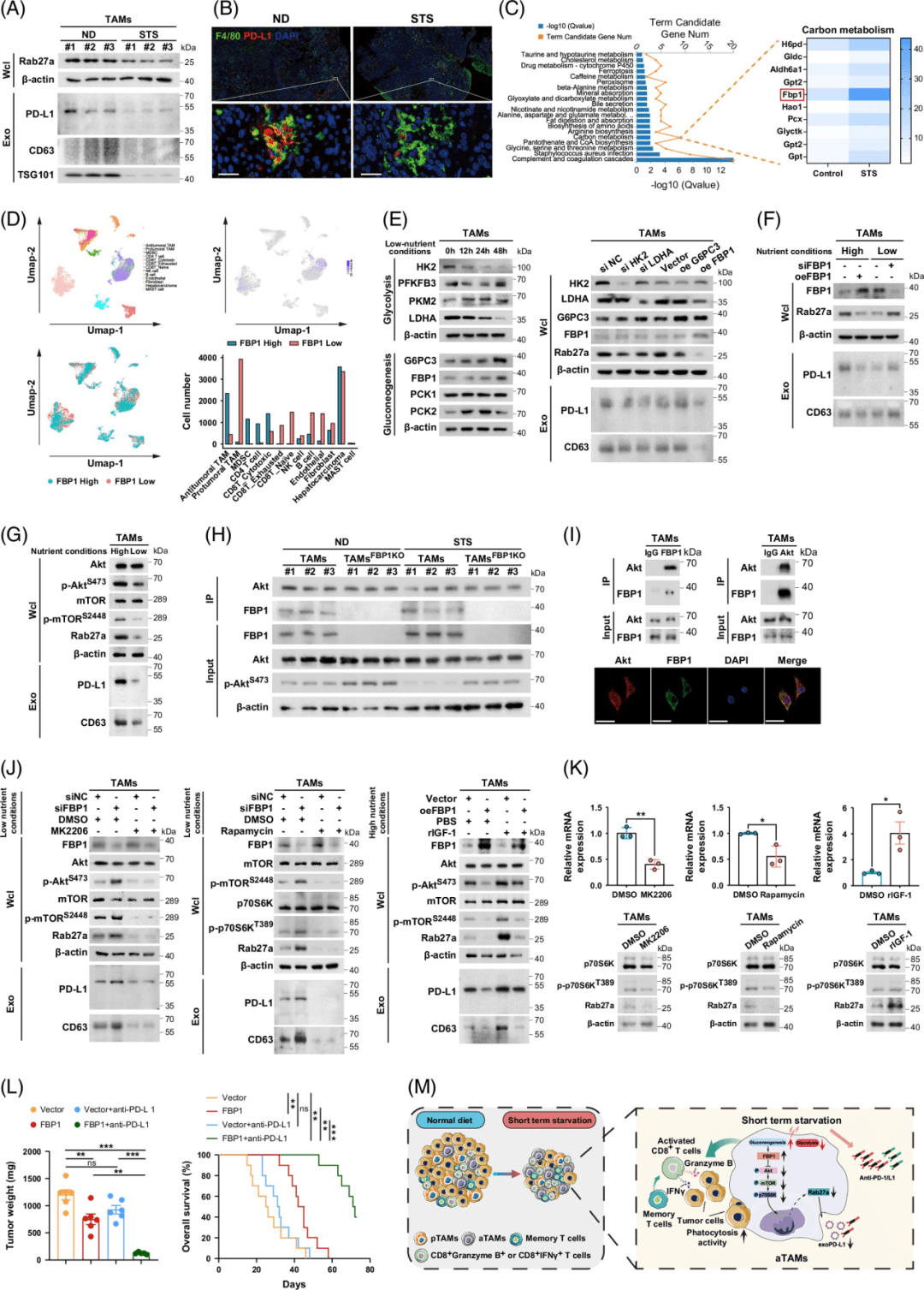
在不同营养条件下,观察到TAM中FBP1水平与Rab27a和exoPD-L1表达呈负相关(图7F)
研究发现,STS能够通过诱导肿瘤相关巨噬细胞(TAMs)向抗肿瘤表型转变、增强对肿瘤细胞的吞噬作用以及激活CD8+ T细胞的后续抗肿瘤免疫反应,从而抑制肿瘤进展。该结论在3种肝细胞癌(HCC)小鼠模型、NCG小鼠和Rag2-KO小鼠中均得到验证。
结 论
本研究描述了STS的免疫调节作用,并为其作为HCC免疫治疗佐剂的应用提供了理论基础研究,为营养疗法和免疫疗法联合治疗HCC患者的疗效提供了强有力的临床前证据。在健康的身体中,免疫细胞倾向于寻求一个“避风港”来应对营养挑战。
参考文献
1:Stem Cell Ophthalmology Treatment Study (SCOTS) for retinal and optic nerve diseases
免责声明:本文旨在科普相关知识,不作为医疗指导意见
编辑|Zhang.ZG
审核|Geng.ZG

