
癌症,这个令人闻之色变的疾病,一直是人类健康的重大威胁。在众多癌症类型中,T细胞恶性肿瘤因其复杂的病理机制和治疗难度,成为了医学界亟待攻克的难题。传统的治疗方法如化疗、放疗等,虽然在一定程度上能够缓解病情,但往往伴随着严重的副作用,且疗效有限,复发率较高。
近年来,嵌合抗原受体T(CAR-T)细胞疗法的出现,为T细胞恶性肿瘤的治疗带来了新的曙光。这种创新的免疫治疗方法通过基因工程技术改造患者自身的T细胞,使其能够特异性识别并攻击肿瘤细胞,展现出了巨大的治疗潜力。CAR-T细胞疗法真的能成为攻克T细胞恶性肿瘤的“终极武器”吗?今天,我们就来深入探讨一下CAR-T细胞疗法在T细胞恶性肿瘤治疗中的最新进展。
认识T细胞恶性肿瘤
T细胞恶性肿瘤是一组起源于T细胞的异质性疾病,包括外周T细胞淋巴瘤(PTCL)、皮肤T细胞淋巴瘤(CTCL)、T淋巴细胞白血病/淋巴瘤(T-ALL/LBL)、成人T细胞白血病/淋巴瘤(ATLL)以及自然杀伤(NK)/T细胞淋巴瘤(NKTCL)等多种亚型。这些亚型在发病机制、临床表现、疾病进展速度和治疗反应等方面存在显著差异。
PTCL 是一种常见的非霍奇金淋巴瘤,具有高度异质性,缺乏明确的分子标志物和统一的形态学特征,治疗难度较大,患者的中位生存期较短。CTCL主要影响皮肤,早期可采用局部治疗,但晚期常出现耐药和转移,严重影响患者生活质量,且因免疫功能缺陷导致感染风险增加,死亡率较高。T-ALL/LBL多见于儿童和年轻人,病情进展迅速,传统治疗方法的复发率高,5年生存率相对较低。ATLL由人类T细胞白血病病毒1型(HTLV-1)感染引起,主要发生在流行地区的成年人中,治疗选择有限,预后不良。NKTCL与EBV感染密切相关,多发生于亚洲和拉丁美洲,对常规化疗耐药,预后较差。
CAR-T细胞疗法的基本原理
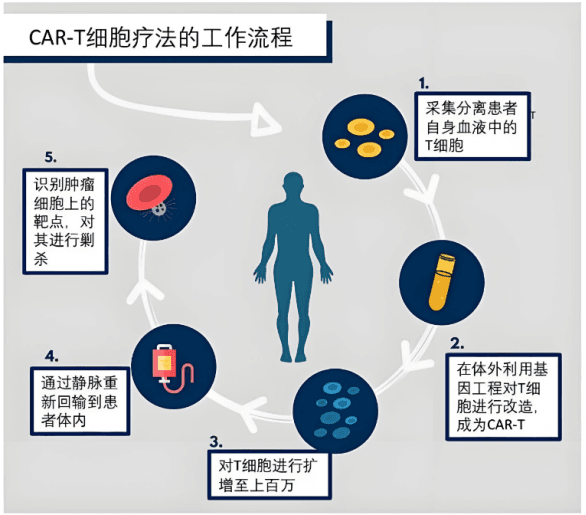
CAR-T细胞疗法的核心原理是利用基因工程技术,为患者的T细胞装备上能够特异性识别肿瘤抗原的嵌合抗原受体(CAR)。这些经过改造的T细胞在回输到患者体内后,就像一支精准的“特种部队”,能够凭借CAR迅速识别并结合肿瘤细胞表面的抗原,进而激活一系列免疫反应,对肿瘤细胞发起攻击。
CAR的结构包含多个关键部分。胞外抗原结合域通常来源于单克隆抗体,它决定了CAR-T细胞对肿瘤抗原的特异性识别能力,就像“导航系统”,精准指引T细胞找到肿瘤细胞。跨膜区起到连接胞外和胞内结构的桥梁作用,确保信号的有效传递。胞内信号传导域则负责将识别信号转化为激活T细胞的指令,启动T细胞的免疫应答,促使其释放细胞因子、增殖并发挥细胞毒性作用,对肿瘤细胞进行杀伤。
CAR-T细胞疗法的临床研究进展
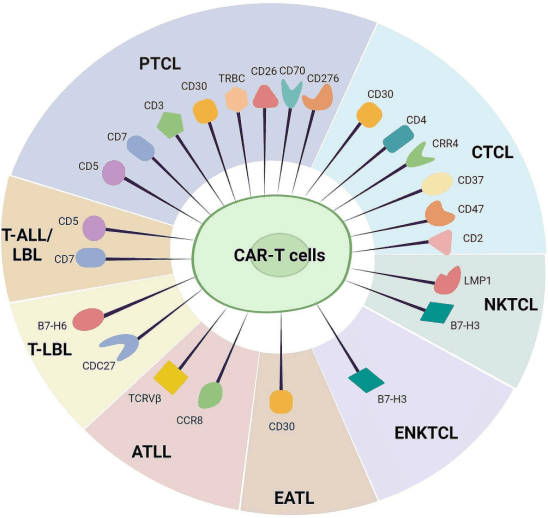
在T细胞恶性肿瘤的治疗中,CAR-T细胞疗法的临床研究取得了一系列重要进展,多个靶点的研究正在积极开展,为患者带来了新的希望。
CD5靶点的研究显示,其在多种T细胞恶性肿瘤中广泛表达,使其成为一个潜在的泛T细胞抗原靶点。在针对CD5的研究中,通过基因编辑技术如CRISPR-Cas9敲低CD5表达,或采用特定的CAR结构设计,如结合CD28或4-1BB等共刺激域,可增强CAR-T细胞的活性和疗效。一些临床研究表明,CD5CAR-T细胞治疗在部分患者中实现了较好的缓解效果,但也面临着如T细胞再生障碍等挑战,需要进一步优化治疗策略。
CD7靶点在T-ALL和部分PTCL亚型中高度表达。多项临床试验探索了CD7CAR-T细胞治疗的安全性和有效性,初步结果显示出较高的完全缓解率,但也伴随着如细胞因子释放综合征(CRS)等副作用。为了提高疗效和安全性,研究人员正在探索联合治疗策略,如在CAR-T细胞治疗后序贯异基因造血干细胞移植(HSCT),以及开发新型的CAR-T细胞产品,如通用型CAR-T细胞,以降低移植物抗宿主病(GvHD)的风险。
T细胞受体β链恒定区(TRBC)靶点的研究为PTCL治疗提供了新方向。通过靶向TRBC1或TRBC2,CAR-T细胞能够特异性识别并清除表达相应TRBC亚型的恶性T细胞,同时保留正常T细胞,减少对免疫系统的损害。目前的研究正在进一步优化治疗方案,以提高疗效并降低潜在的副作用。
案例分享
T细胞恶性肿瘤是一种很难治疗的癌症,因为它们经常复发,而且目前没有太多有效的治疗方法。即使使用了多种化疗药物,成人和儿童的生存率仍然很低。CAR-T细胞疗法是一种免疫疗法,它通过改造病人的T细胞来攻击癌细胞。但是,这种疗法在治疗T细胞恶性肿瘤时遇到了一些问题,比如可能会误伤正常的T细胞(称为“自相残杀”),增加感染风险,以及癌细胞可能会逃避免疫系统的攻击。
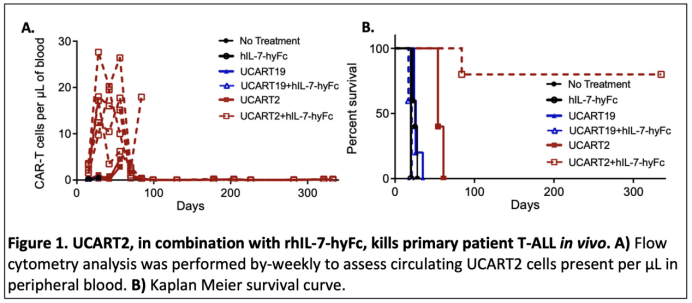
为了解决这些问题,研究人员开发了一种新的CAR-T细胞疗法,称为UCART2。这种疗法通过CRISPR/Cas9基因编辑技术,同时删除了T细胞上的CD2和T细胞受体α亚单位,这样可以防止自相残杀和移植物抗宿主病(GvHD)。研究人员在实验室里测试了UCART2的效果,发现它能够有效地对抗T-ALL和CTCL细胞,并且在动物模型中延长了肿瘤植入小鼠的生存时间。研究人员还发现,如果CAR-T细胞缺少CD2,它们产生的效应细胞因子(比如Granzyme-B和IFN-γ)会减少,这会影响它们对抗肿瘤的能力。但是,当UCART2与一种长效的重组人白介素-7(rhIL-7-hyFc,商品名efneptakin alfa)联合使用时,可以增强UCART2在体内的扩增和持久性,从而提高小鼠的生存率。
挑战与应对策略
尽管CAR-T细胞疗法在T细胞恶性肿瘤治疗中取得了显著进展,但仍面临诸多挑战。
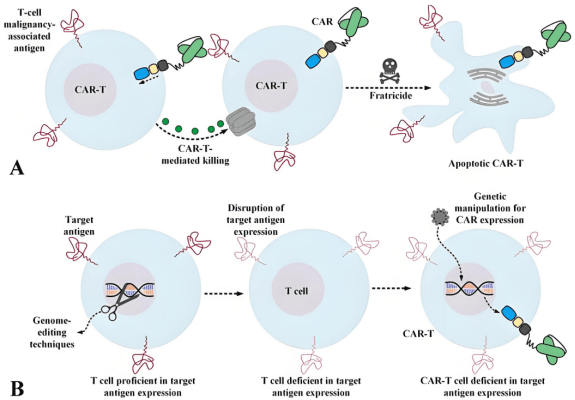
“自相残杀”(Fratricide)现象是一个重要问题。由于T细胞表面的抗原在正常T细胞和CAR-T细胞自身上也有表达,在CAR-T细胞制备过程中,这些细胞可能会相互攻击,导致细胞数量减少和功能受损。为了解决这一问题,研究人员采用了多种策略,包括利用基因编辑技术敲除或下调CAR-T细胞上的特定靶抗原,如CD7和CD5;开发双特异性或多特异性CAR,通过“逻辑门控”机制更精准地识别肿瘤细胞;以及寻找仅在恶性细胞上表达的靶抗原,减少对正常细胞的攻击。
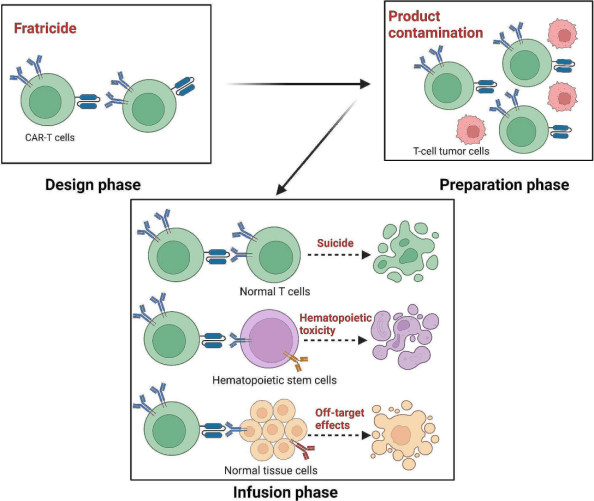
CAR-T细胞产品污染也是一个潜在风险。在治疗过程中,需要确保CAR-T细胞产品不被恶性T细胞或其他杂质污染,否则可能影响治疗效果并导致疾病恶化。为降低污染风险,研究人员正在探索使用特定的非疾病相关T细胞亚群来制备CAR-T细胞,同时加强对细胞采集、制备和输注过程的质量控制,确保产品的安全性和有效性。
输注后不良反应是需要密切关注的问题。其中,“自杀”现象是指CAR-T细胞在输注后不仅攻击肿瘤细胞,还会攻击表达相同抗原的正常T细胞,导致严重的免疫缺陷和感染风险增加。为减轻这种风险,研究人员正在探索多种方法,如优化CAR结构以提高特异性,减少对正常细胞的攻击;利用基因编辑技术去除内源性T细胞受体(TCR)和免疫检查点蛋白,增强CAR-T细胞的抗肿瘤活性并降低自身免疫反应;以及开发自杀基因系统,如单纯疱疹病毒胸苷激酶(HSVTK)和诱导型半胱天冬酶-9(iCasp9)等,在必要时能够诱导CAR-T细胞凋亡,避免过度免疫激活。
小结与展望
随着对T细胞恶性肿瘤生物学特性和 CAR-T细胞疗法机制的深入理解,以及技术的不断创新,CAR-T细胞疗法在未来有望取得更大的突破。精准医疗将在CAR-T细胞疗法中发挥越来越重要的作用。通过对患者肿瘤细胞和免疫系统的精准分析,能够更准确地选择合适的靶点和治疗方案,实现个性化治疗,提高治疗效果并减少副作用。例如,根据患者肿瘤细胞的特定抗原表达谱,定制个性化的 CAR-T细胞产品,使其能够更精准地识别和攻击肿瘤细胞。
新型CAR结构的设计和优化将持续推进。研究人员将不断探索更有效的共刺激域组合、抗原结合域亲和力优化以及CAR分子的修饰,以增强CAR-T细胞的活性、持久性和安全性。同时,多靶点CAR-T细胞疗法的研究也将不断深入,通过同时靶向多个肿瘤相关抗原,提高治疗的精准性和疗效,减少肿瘤细胞逃逸的风险。
除了在血液系统恶性肿瘤中的应用,CAR-T细胞疗法在实体瘤治疗中的研究也将取得进展。尽管目前CAR-T细胞疗法在实体瘤治疗中面临诸多挑战,如肿瘤微环境的抑制作用、靶点选择困难等,但随着研究的深入,有望开发出更有效的策略来克服这些障碍,为实体瘤患者带来新的治疗选择。
参考文献
[1] An "Off-the-Shelf" CD2 Universal CAR-T Therapy Combined with a Long-Acting IL-7 forT-Cell Malignancies;
[2] Advances in CAR-T-cellTherapy inT-cell malignancies.
免责声明:本文旨在科普相关知识,不作为医疗指导意见。
编辑|Yuanyuan.ZG
审核|Geng.ZG

